
Bufferløsningsegenskaper, tilberedning, eksempler

De bufferløsninger eller buffere er de som kan redusere pH-endringer på grunn av H-ioner3ELLER+ og OH-. I fravær av disse blir noen systemer (for eksempel fysiologiske) skadet, siden komponentene deres er veldig følsomme for plutselige endringer i pH.
Akkurat som støtdempere i biler reduserer belastningen forårsaket av bevegelse, gjør buffere det samme, men med surheten eller grunnleggende løsningen. Videre etablerer buffere et spesifikt pH-område der de er effektive..

Ellers er H-ionene3ELLER+ de vil forsure løsningen (pH synker til verdier under 6), noe som medfører en mulig endring i utbyttet av reaksjonen. Det samme eksemplet kan brukes for grunnleggende pH-verdier, det vil si større enn 7.
Artikkelindeks
- 1 Funksjoner
- 1.1 Sammensetning
- 1.2 De nøytraliserer både syrer og baser
- 1.3 Effektivitet
- 2 Klargjøring
- 3 eksempler
- 4 Referanser
Kjennetegn
Sammensetning
De er i det vesentlige sammensatt av en syre (HA) eller en svak base (B), og salter av deres konjugerte base eller syre. Følgelig er det to typer: syrebuffere og alkaliske buffere..
Syrebuffere tilsvarer HA / A-paret-, hvor til- er den konjugerte basen til den svake syren HA og samhandler med ioner - slik som Na+- for å danne natriumsalter. På denne måten forblir paret som HA / NaA, selv om de også kan være kalium- eller kalsiumsalter.
Avledet fra den svake syren HA, buffrer den sure pH-områder (mindre enn 7) i henhold til følgende ligning:
HA + OH- => A- + HtoELLER
Men som en svak syre, blir dens konjugatbase delvis hydrolysert for å regenerere en del av det forbrukte HA:
TIL- + HtoELLER <=> HA + OH-
På den annen side består alkaliske buffere av B / HB-paret+, hvor HB+ det er den konjugerte syren til den svake basen. Vanligvis HB+ danner salter med kloridioner, og etterlater paret som B / HBCl. Disse bufferne buffer grunnleggende pH-områder (større enn 7):
B + H3ELLER+ => HB+ + HtoELLER
Og igjen, HB+ kan delvis hydrolyseres for å regenerere en del av forbrukt B:
HB+ + HtoELLER <=> B + H3ELLER+
De nøytraliserer både syrer og baser
Mens sure buffere buffer sur pH og basisk buffere basisk pH, kan begge reagere med H-ioner.3ELLER+ og OH- gjennom disse serien av kjemiske ligninger:
TIL- + H3ELLER+ => HA + HtoELLER
HB+ + Åh- => B + HtoELLER
Dermed, når det gjelder HA / A-paret-, HA reagerer med OH-ioner-, mens A- -den konjugerte basen reagerer med H3ELLER+. Angående B / HB-paret+, B reagerer med H-ioner3ELLER+, mens HB+ -dens konjugerte syre - med OH-.
Dette gjør at begge buffere kan nøytralisere både sure og basiske arter. Resultatet av ovennevnte versus for eksempel den konstante tilsetning av mol OH-, er reduksjonen i pH-variasjonen (ΔpH):
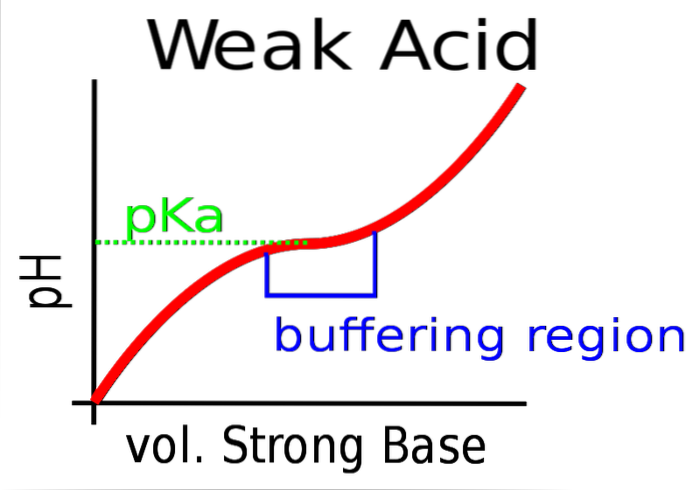
Det øvre bildet viser buffringen av pH mot en sterk base (donor av OH-).
Opprinnelig er pH sur på grunn av tilstedeværelsen av HA. Når den sterke basen tilsettes, dannes de første mol A- og bufferen begynner å tre i kraft.
Imidlertid er det et område av kurven der skråningen er mindre bratt; det vil si hvor demping er mer effektiv (blåaktig boks).
Effektivitet
Det er flere måter å forstå konseptet med dempningseffektivitet. En av disse er å bestemme det andre derivatet av kurven pH versus basevolumet, og løse for V for minimumsverdien, som er Veq / 2.
Veq er volumet ved ekvivalenspunktet; dette er volumet av basen som trengs for å nøytralisere all syren.
En annen måte å forstå det på er gjennom den berømte ligningen Henderson-Hasselbalch:
pH = pKtil + logg [[B] / [A])
Her betegner B basen, A syren og pKtil er den minste logaritmen til surhetskonstanten. Denne ligningen gjelder både for syrearten HA, og for den konjugerte syren HB+.
Hvis [A] er veldig stor med hensyn til [B], tar loggen () en veldig negativ verdi, som trekkes fra pKtil. Hvis [A] derimot er veldig liten med hensyn til [B], får verdien av log () en veldig positiv verdi, som legges til pKtil. Når [A] = [B] er loggen () imidlertid 0 og pH = pKtil.
Hva betyr alt det ovennevnte? At ΔpH vil være større i ekstremene som er vurdert for ligningen, mens det vil være minimum med en pH lik pKtil; og som pKtil er karakteristisk for hver syre, bestemmer denne verdien pK-områdettil± 1.
PH-verdiene innenfor dette området er de hvor bufferen er mest effektiv..
Forberedelse
For å utarbeide en bufferløsning må du huske følgende trinn:
- Kjenn til den nødvendige pH og derfor den du vil holde så konstant som mulig under reaksjonen eller prosessen.
- Å vite pH, man ser etter alle svake syrer, de som har pKtil er nærmere denne verdien.
- Etter å ha valgt HA-arten og beregnet konsentrasjonen av bufferen (avhengig av hvor mye base eller syre som må nøytraliseres), veies den nødvendige mengden av natriumsaltet..
Eksempler
Eddiksyre har en pKtil av 4,75, CH3COOH; derfor en blanding av visse mengder av denne syren og natriumacetat, CH3COONa, danner en buffer som effektivt buffrer i pH-området (3,75-5,75).
Andre eksempler på monoprotiske syrer er benzoesyrer (C6H5COOH) og formisk (HCOOH). For hver av disse er deres pK-verdiertil de er 4,18 og 3,68; derfor er deres høyeste buffer-pH-områder (3.18-5.18) og (2.68-4.68).
På den annen side er polyprotiske syrer som fosforsyre (H3PO4) og karbon (HtoCO3) har like mange pK-verdiertil slik protoner kan frigjøres. Dermed har H3PO4 har tre pKtil (2.12, 7.21 og 12.67) og HtoCO3 har to (6 352 og 10 329).
Hvis du vil opprettholde en pH på 3 i en løsning, kan du velge mellom HCOONa / HCOOH (pKtil= 3,68) og NaHtoPO4/ H3PO4 (pKtil= 2,12).
Den første bufferen, for maursyre, er nærmere pH 3 enn fosforsyrebufferen; derfor buffrer HCOONa / HCOOH bedre ved pH 3 enn NaHtoPO4/ H3PO4.
Referanser
- Day, R., & Underwood, A. Kvantitativ analytisk kjemi (femte utg.). PEARSON Prentice Hall, s 188-194.
- Avsar Aras. (20. april 2013). Mini støt. Hentet 9. mai 2018 fra: commons.wikimedia.org
- Wikipedia. (2018). Bufferløsning. Hentet 9. mai 2018 fra: en.wikipedia.org
- Assoc. Prof. Lubomir Makedonski, PhD. [Dok.]. Bufferløsninger. Medisinske universitetet i Varna.
- Chem Collective. Bufferveiledninger. Hentet 9. mai 2018 fra: chemcollective.org
- spørIITere. (2018). Bufferløsning. Hentet 9. mai 2018 fra: askiitians.com
- Quimicas.net (2018). Eksempler på buffer-, buffer- eller bufferløsninger. Hentet 9. mai 2018 fra: quimicas.net


Ingen har kommentert denne artikkelen ennå.