
Kalsiumsulfat (CaSO4) Kjemisk struktur, egenskaper, bruksområder

De kalsiumsulfat Det er et ternært salt av kalsium, jordalkalimetall (Mr. Becambara), svovel og oksygen. Den kjemiske formelen er CaSO4, som betyr at for hvert kation Cato+ det er et anion så4to- samhandle med det. Det utgjør en forbindelse med bred distribusjon i naturen.
Dens mest utbredte former er CaSO42HtoO (gips) og den vannfrie formen CaSO4 (anhydritten). Det er også en tredje form: gips av Paris, produsert ved oppvarming av gipset (hemidratet, CaSO)41 / 2HtoELLER). En solid del av dette ternære saltet er vist i det nedre bildet, med sitt hvite utseende..

Artikkelindeks
- 1 Kjemisk struktur
- 2 eiendommer
- 2.1 Molekylformel
- 2.2 Vannfri molekylvekt
- 2.3 Lukt
- 2.4 Utseende
- 2,5 Tetthet
- 2.6 Smeltepunkt
- 2.7 Løselighet
- 2.8 Stabilitet
- 3 bruksområder
- 3.1 I konstruksjon og kunst
- 3.2 Terapi
- 3.3 I matforedling
- 3.4 Som gjødsel og balsam for avling av jord
- 3.5 Ved produksjon av andre forbindelser
- 4 Referanser
Kjemisk struktur
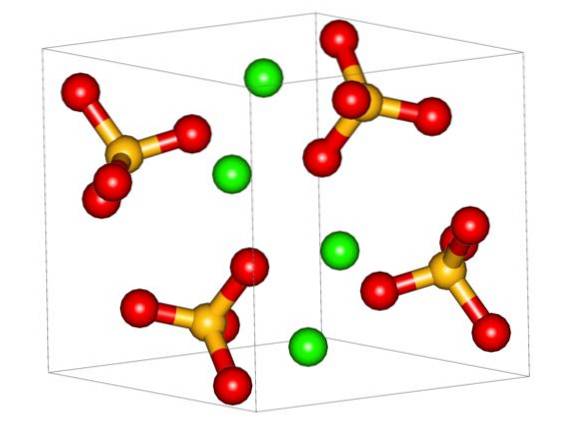
Det øvre bildet viser den ortorhombiske enhetscellen for CaSO4. Her antas det at samspillet er rent elektrostatisk; det vil si kationene Cato+ tiltrekke seg tetraedriske anioner SO4to-.
Imidlertid Cato+ det er svært utsatt for å koordinere, og danner polyhedrale strukturer rundt det. For hva er dette? Til den elektroniske tilgjengeligheten av kalsium for å akseptere elektroner av basiske eller negative arter (for eksempel O-atomer av SO4to-).
Tatt i betraktning det forrige punktet, nå Ca-ioneneto+ De godtar dative lenker (levert av Os) og enhetscellen blir transformert, som angitt i bildet nedenfor:
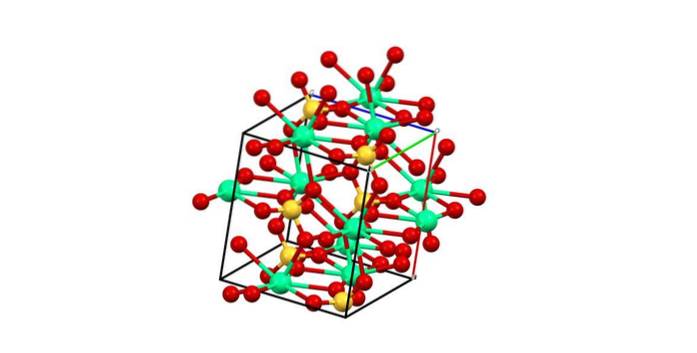
Følgelig dannes polyhedronet CaO8 (den grønne sfæren til Cato+ omgitt av åtte røde kuler av O fra SO tetraeder4 i nærheten). Kalsiumpolyeder og sulfattetraeder; dette er den krystallinske strukturen til CaSO4 vannfri.
I tillegg, når krystallene hydreres - danner det dihydrerte saltet eller hemidratet (CaSO41/2 HtoO) - strukturen utvides til å inkludere vannmolekyler.
Disse molekylene kan interkalere og koordinere seg med kalsium; det vil si at de erstatter en eller to sulfatgrupper.
På den annen side blir ikke alt vannet en del av CaO polyhedronet.8. Noen danner derimot hydrogenbindinger med sulfater. Disse fungerer som en forening for to sikksakk-seksjoner, produkter av arrangementet av ionene i krystallet.
Eiendommer
Molekylær formel
CaSO4 nH2O.
Vannfri molekylvekt
136,134 g / mol.
Lukt
Det er luktfritt.
Utseende
Når det gjelder anhydrid, ser det ut som et hvitt pulver eller faste ortorhombiske eller monokliniske krystaller. Krystallene har variabel farge: de kan være hvite eller med en blåaktig, gråaktig eller rødaktig fargetone; kan også være mursteinrød.
Tetthet
2,96 g / cm3 (vannfri form). 2,32 gr / cm3 (dihydratform).
Smeltepunkt
1450 ° C (2840 ° F). Karakteristisk for sterke elektrostatiske interaksjoner mellom toverdige Ca-ionerto+ Og så4to-.
Løselighet
0,2-0,3% i vann ved 25 ° C. Det er dårlig løselig i vann og uoppløselig i etanol.
Stabilitet
Stabil ved romtemperatur.
applikasjoner

I bygg og kunst
Den brukes i utarbeidelsen av stuk for å fryse veggene i hjemmene og andre konstruksjoner som bidrar til forskjønnelsen. I tillegg lages relieffer ved hjelp av former i tak og vinduskarmer. Gipset er også i taket.
Kalsiumsulfat brukes til å løse problemet som oppstår i hydrering av betong, og samarbeider dermed om bygging av veier, veier osv..
Med gips er det laget skulpturer, spesielt religiøse figurer, og på kirkegårder brukes de på gravsteiner.
Terapeutikk
veterinær
Eksperimentelt har sterilbiter av kalsiumsulfat i veterinærmedisin blitt brukt til å reparere beinfeil eller hulrom, slik som de som er igjen av sår eller svulster..
Plaster of Paris kan brukes til å reparere beinfeil på grunn av sin unike evne til å stimulere osteogenese. Røntgenstudier og technetium (Tc99m) medronat støtter bruken av gips av Paris som en alloplast og dets osteogene kapasitet når den implanteres i frontal sinus.
Benregenerering har blitt demonstrert hos seks hunder i en periode på 4 til 6 måneder. Kalsiumsulfat begynte å bli brukt i dette feltet i 1957, i form av gips av Paris-tabletter, som var i stand til å fylle feil i beinene til hunder..
Bensubstitusjonen av kalsiumsulfat er sammenlignbar med den som er observert i autogent bein.
Ruhaimi (2001) påførte kalsiumsulfat på et nylig ødelagt kaninkjebben, og observerte en økning i osteogenese og beinkalk..
Medisin
Kalsiumsulfat brukes i medisin for å immobilisere forvredne ledd og knuste bein, i tillegg til å brukes som et hjelpestoff ved fremstilling av tabletter..
odontologi
I tannlegen brukes det som grunnlag for å lage tannproteser, i restaureringer og inntrykk av tennene..
I matforedling
Den brukes som et koagulasjonsmiddel i produksjonen av tofu, en mat laget med soya og mye konsumert i østlige land som erstatning for kjøtt. I tillegg har den blitt brukt som oppstramming av mat og til behandling av mel.
Som gjødsel og balsam for avling av jord
Gips (CaSO42HtoO) ble brukt som gjødsel i Europa siden det attende århundre, og hadde fordelen over bruk av kalk som kilde til kalsium for større mobilitet.
Kalsium må være tilgjengelig for plantens røtter for tilstrekkelig forsyning. Så tilsetning av kalsium forbedrer avlingene i hagebruk og jordnøtt (peanøtter)..
Peanøtterot forårsaket av biologiske patogener, i tillegg til vannmelon og tomatråte, er delvis kontrollert med gipsapplikasjoner i landbruket..
Gips bidrar til å redusere spredningen av leire, noe som forårsaker dannelse av skorper på bakken. Ved å redusere skorpene som dannes på bakken, letter gipset utgangen av plantene. Det øker også tilgangen til luft og vann til bakken.
Gips bidrar til å forbedre jorda ved å dempe surheten og toksisiteten til aluminium, og dermed tilpasse avlingen til natriumjord.
Ved produksjon av andre forbindelser
Kalsiumsulfat reagerer med ammoniumbikarbonat og danner ammoniumsulfat. Det har også blitt brukt i produksjonsprosessen av svovelsyre.
Vannfritt kalsiumsulfat blandes med skifer eller magert, og når blandingen oppvarmes, frigjøres svoveltrioksid i gassform. Svoveloksid er en forløper for svovelsyre.
Referanser
- Røykfot. (26. desember 2015). Struktur av CaSO4. [Figur]. Hentet 6. mai 2018 fra: commons.wikimedia.org
- Takanori Fukami et al. (2015). Syntese, krystallstruktur og termiske egenskaper av CaSO42HtoEller enkeltkrystaller. International Journal of Chemistry; Bind 7, nr. 2; ISSN 1916-9698 E-ISSN 1916-9701 Publisert av Canadian Center of Science and Education.
- PubChem. (2018). Kalsiumsulfat. Hentet 6. mai 2018 fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Kalsiumsulfat. Hentet 6. mai 2018 fra: en.wikipedia.org
- Elsevier. (2018). kalsiumsulfat. Hentet 6. mai 2018 fra: sciencedirect.com
- Kimberlitesoftwares. (2018). Kalsiumsulfat. Hentet 6. mai 2018 fra: worldofchemicals.com
- Intagri. (2017). Håndbok for bruk av jordbruksgips som jordforbedrer. Hentet 6. mai 2018 fra: intagri.com


Ingen har kommentert denne artikkelen ennå.