
Natriumsulfidformler, bruksområder, risiko
De natriumsulfid (Na2S) er et gul til mursteinrødt krystallinsk fast stoff. I naturen finnes det i forskjellige grader av hydrering, den vanligste er natriumsulfid nonahydrat (Na2S 9H2O).
De er vannløselige salter som gir sterkt alkaliske løsninger. Når de utsettes for fuktig luft, absorberer de fuktighet fra luften og kan varme opp spontant og forårsake antenning av nærliggende brennbare materialer. I kontakt med fuktig luft avgir de også hydrogensulfid, som lukter råtne egg..

De er sterke reduksjonsmidler. Disse stoffene kan være farlige for miljøet, spesielt for vannlevende organismer.
Natriummonosulfid leveres kommersielt i flakform som inneholder 60-62% NatoS ...
- Formler

- CAS: 1313-82-2 Natriumsulfid (vannfri)
- CAS: 1313-84-4 Sodium sulfide (nonahydrate)
2D-struktur
3D-struktur

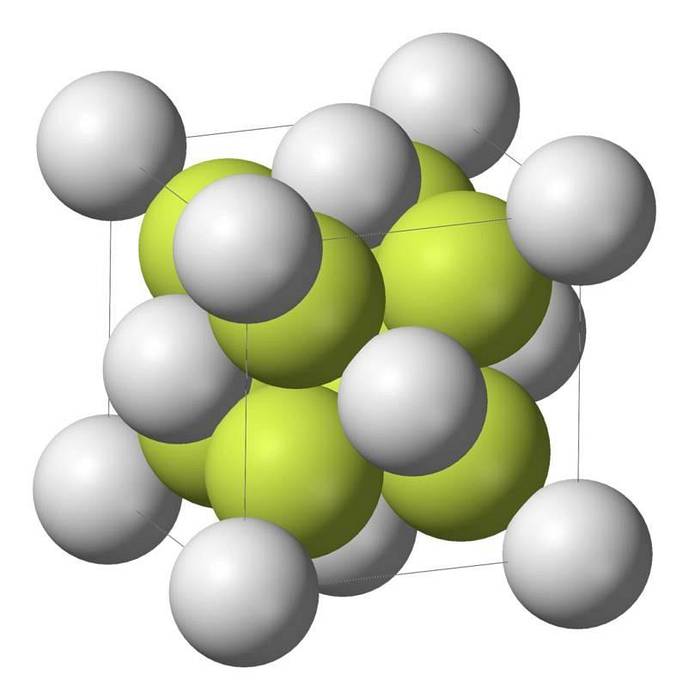
Kjennetegn ved natriumsulfid
Fysiske og kjemiske egenskaper

Natriummonosulfid (Na2S) krystalliserer med antifluorittstrukturen, der hvert S-atom er omgitt av en terning med 8 Na-atomer og hvert Na-atom av en tetraeder med 4 S-atomer..
Brennbarhet
Det eneste lettantennelige medlemmet av den uorganiske sulfidgruppen er hydrogensulfid. Imidlertid kan noen andre uorganiske sulfider, som natriumsulfid, spontant varme opp og til og med antennes hvis de blir utsatt for fuktighet..
Når det utsettes for brann, frigjør natriumsulfid svoveldioksydgasser eller damper som er irriterende eller giftige.
Reaktivitet
- Uorganiske sulfider er generelt basiske (noen er sterkt basiske og derfor uforenlige med syrer).
- Mange av disse forbindelsene er reduksjonsmidler (de reagerer kraftig med oksidasjonsmidler).
- Enkle sulfidsalter (som natrium, kalium og ammoniumsulfid) reagerer kraftig med syrer for å frigjøre svært giftig og brennbar hydrogensulfidgass..
- Sodium Sulfide er brannfarlig. Kan eksplodere når det varmes raskt opp eller treffer.
- Ved oppvarming til nedbrytning avgir den giftige røyk av natriumoksid og svoveloksider.
- Reagerer voldsomt med karbon, kull, diazoniumsalter, N, N-diklormetylamin, sterke oksidanter og vann.
Toksisitet
Mange av medlemmene i den uorganiske sulfidgruppen oppfører seg som sterke baser, og kan forårsake alvorlige forbrenninger ved hudkontakt..
Denne egenskapen avhenger av dens løselighet. De mer uoppløselige uorganiske sulfidene (for eksempel kvikksølv (II) sulfid og kadmiumsulfid) er ikke etsende.
Sodium sulfide har en middels oktanol / vann-fordelingskoeffisient (Pow) (på -3,5). Denne verdien brukes som et mål på løselighet (og biokonsentrasjon) av et stoff i animalsk fettvev (spesielt vannlevende dyr)..
Natriumsulfid anses å være farlig for miljøet, spesielt for vannlevende organismer.
applikasjoner
I hjemmet brukes natriumsulfid i avløpsrengjøringsmidler, husholdningsrengjøringsmidler (til ovnen, badet), rettetang, oppvaskmaskinsåpe og bilsekk..
I industrien brukes det i rengjøringsmidler, i sement og som en forløper for produksjon av andre kjemikalier.
Kliniske effekter
Eksponering for natriumsulfid er vanlig i utviklede og underutviklede land, både i industrien og hjemme. Disse etsende stoffene er tilstede i forskjellige husholdningsprodukter i lave konsentrasjoner..
I utviklede land er alvorlige effekter sjeldne. Disse forekommer primært fra bevisst inntak av kjemikaliet hos voksne. Imidlertid er alvorlige effekter i utviklingsland vanligere.
Alkaliske etsende stoffer forårsaker kondenseringsnekrose. De forsapper fettene i cellemembranen, ødelegger cellen og tillater dyp penetrasjon i slimhinnevevet.
Oral eksponering
Innledende betennelse oppstår i gastrointestinalt vev, etterfulgt av vevsnekrose (med mulig perforering), deretter granulering og til slutt dannelse av striktur.
Pasienter med mild inntakelse utvikler grad I-irritasjon eller forbrenning (overfladisk hyperemi og ødem) i oropharynx, spiserøret eller magen..
Pasienter med moderat forgiftning kan utvikle grad II forbrenning (overfladiske blemmer, erosjoner og sårdannelser) med mulig etterfølgende dannelse av strengdannelse (spesielt spiserør)..
Noen pasienter (spesielt små barn) kan utvikle øvre luftveisødem.
Pasienter med alvorlig rus ved svelging kan utvikle dype brannskader og nekrose i mage-tarmslimhinnen, med komplikasjoner som: perforering (spiserør, gastrisk, sjelden duodenal), fisteldannelse (trakeøsofageal, aortøsofageal) og gastrointestinal blødning..
Kan utvikle seg: hypotensjon, takykardi, takypné, dannelse av striktur (hovedsakelig spiserør), spiserørskreft og øvre luftveisødem (som er vanlig og ofte livstruende).
Alvorlig rus er generelt begrenset til bevisst inntak hos voksne.
Eksponering for innånding
Mild eksponering kan forårsake hoste og bronkospasme.
Alvorlig innånding kan forårsake ødem i øvre luftveier, brannskader, stridor og sjelden akutt lungeskade..
Okulær eksponering
Det kan forårsake alvorlig konjunktival irritasjon og kjemose, hornhinneepiteldefekter, limbisk iskemi, permanent synstap og i alvorlige tilfeller av perforering.
Dermal eksponering
Mild eksponering forårsaker irritasjon og delvis tykkelse. Metabolisk acidose kan utvikles hos pasienter med alvorlige forbrenninger eller sjokk..
Langvarig eksponering eller høykonsentrasjonsprodukter kan forårsake brannskader i full tykkelse.
Sikkerhet og risiko
Faresetninger fra det globalt harmoniserte systemet for klassifisering og merking av kjemikalier (GHS)
Det globalt harmoniserte systemet for klassifisering og merking av kjemikalier (GHS) er et internasjonalt avtalt system, laget av FN og designet for å erstatte de forskjellige klassifiserings- og merkingsstandardene som brukes i forskjellige land ved å bruke konsistente kriterier globalt..
Fareklassene (og deres tilhørende GHS-kapittel), standarder for klassifisering og merking og anbefalinger for natriumsulfid er som følger (European Chemicals Agency, 2017; FN, 2015; PubChem, 2017):







Referanser
- Benjah-bmm27, (2006). Fluoritt-enhet-celle-3D-ionisk [bilde] Gjenopprettet fra: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [image] Gjenopprettet fra: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D-struktur av 1313-82-2 - Sodium sulfide [image] Gjenopprettet fra: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D-struktur av 1313-84-4 - Sodium sulfide [image] Gjenopprettet fra: chem.nlm.nih.gov.
- European Chemicals Agency (ECHA). (2017). Sammendrag av klassifisering og merking.
- Harmonisert klassifisering - Vedlegg VI til forordning (EF) nr. 1272/2008 (CLP-forordningen). Natriumsulfid. Hentet 16. januar 2017 fra: echa.europa.eu.
- European Chemicals Agency (ECHA). (2017). Sammendrag av klassifisering og merking.
- Varslet klassifisering og merking. Natriumsulfid, hydrert. Hentet 16. januar 2017 fra: echa.europa.eu.
- Databank for farlige stoffer (HSDB). TOXNET. (2017). Natriumsulfid. Bethesda, MD, EU: National Library of Medicine. Gjenopprettet fra: toxnet.nlm.nih.gov.
- Lange, L., & Triebel, W. (2000). Sulfider, polysulfider og sulfaner. I Ullmanns Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA. Gjenopprettet fra dx.doi.org.
- FN (2015). Globalt harmonisert system for klassifisering og merking av kjemikalier (GHS) sjette reviderte utgave. New York, EU: FNs publikasjon. Gjenopprettet fra: unece.org.
- Nasjonalt senter for bioteknologisk informasjon. PubChem Compound Database. (2016). Sodium Sulfide enneahydrate - PubChem Structure [image] Hentet fra: pubchem.ncbi.nlm.nih.gov.
- Nasjonalt senter for bioteknologisk informasjon. PubChem Compound Database. (2017). Sodium monosulfide. Bethesda, MD, EU: National Library of Medicine. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov.
- Nasjonalt senter for bioteknologisk informasjon. PubChem Compound Database. (2017). Sodium Sulfide enneahydrate. Bethesda, MD, EU: National Library of Medicine. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Kjemisk datablad. Vannfri natriumsulfid. Silver Spring, MD. EU; Gjenopprettet fra: cameochemicals.noaa.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Dataark for reaktiv gruppe. Sulfider, uorganiske. Silver Spring, MD. EU; Gjenopprettet fra: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [image] Gjenopprettet fra: wikipedia.org.
- PubChem, (2016). Sodium monosulfide [image] Gjenopprettet fra: puchem.nlm.nih.gov.
- PubChem, (2016). Sodium Sulfide enneahydrate [image] Gjenopprettet fra: puchem.nlm.nih.gov.
- Wikipedia. (2017). Fordelingskoeffisient for oktanol og vann. Hentet 17. januar 2017 fra: wikipedia.org.
- .



Ingen har kommentert denne artikkelen ennå.