
Aromatiske nukleofile substitusjonseffekter, eksempler
De aromatisk nukleofil substitusjon (SNAr) er en reaksjon som forekommer i organisk kjemi, som består av forskyvning av en god forlatende gruppe av en innkommende nukleofil. Fra synspunktet til dens mekanisme og elektroniske aspekter er det motsatt side av den elektrofile aromatiske substitusjonen (SEAr).
Generelt er den utgående gruppen et halogen, som kommer ut som et halogenidanion X-. Denne reaksjonen kan bare finne sted hvis den aromatiske ringen (for det meste benzen) mangler elektroner; det vil si hvis den har elektronuttrekkende substituentgrupper.

Det øvre bildet skisserer det som ble sagt i forrige avsnitt. Elektronattraktorgruppen EWG (for forkortelsen på engelsk: Electron Withdrawing Group), aktiverer den aromatiske ringen for det nukleofile angrepet av den negative arten Nu-. Det kan sees at det dannes et mellomprodukt (i midten) hvorfra halogenidet X frigjøres eller kommer ut-.
Merk at X i enkle termer erstatning for Nu i en aromatisk ring. Denne reaksjonen er veldig allsidig og nødvendig i syntesen av nye legemidler, så vel som i syntetiske organiske kjemistudier..
Artikkelindeks
- 1 Generelle aspekter
- 1.1 Forskjeller med den elektrofile aromatiske substitusjonen
- 2 effekter
- 2.1 Av antall substituenter
- 2.2 Fra den forlate gruppen
- 3 Eksempel
- 3.1 Avsluttende kommentar
- 4 Referanser
Generelle trekk
Den aromatiske ringen kan bli "ladet" eller "utladet" av elektroner, avhengig av hva dens substituenter er (de som erstatter den opprinnelige C-H-bindingen).
Når disse substituentene kan donere elektrondensitet til ringen, sies de å berike den med elektroner; Hvis de tvert imot er tiltrekkere av elektrondensitet (EWG nevnt ovenfor), sies det at de utarmet ringen av elektroner.
I begge tilfeller aktiveres ringen for en spesifikk aromatisk reaksjon, mens den er deaktivert for den andre..
For eksempel sies en elektronrik aromatisk ring å være aktiv for elektrofil aromatisk substitusjon; det vil si at den kan donere elektronene til en elektrofil art, E.+. Imidlertid vil den ikke donere elektroner til en Nu-art-, siden negative ladninger ville frastøte hverandre.
Nå, hvis ringen er dårlig på elektroner, har den ingen måte å gi dem til arten E+ (SEAr forekommer ikke); på den annen side har den tilgjengeligheten til å akseptere elektronene til Nu-arten- (SNAr er utviklet).
Forskjeller med aromatisk elektrofil substitusjon
Når de generelle innsatsaspektene er avklart, kan det nå oppføres noen forskjeller mellom SNAr og SEAr:
- Den aromatiske ringen fungerer som en elektrofil (elektronmangel) og blir angrepet av en nukleofil.
- En forlatende gruppe X er substituert på ringen; ikke en H+
- Karbokasjoner dannes ikke, men mellomledd med en negativ ladning som kan delokaliseres ved resonans
- Tilstedeværelsen av flere tiltrekkergrupper i ringen akselererer substitusjonen i stedet for å bremse den
- Til slutt har disse gruppene ingen direktevirkninger på hvor (på hvilket karbon) substitusjonen vil forekomme. Substitusjonen vil alltid skje på karbonet festet til den utgående gruppen X.
Det siste punktet er også illustrert i bildet: C-X-bindingen brytes for å danne den nye C-Nu-bindingen.
Effekter rediger
Av antall substituenter
Naturligvis, jo mer elektronfattig ringen er, desto raskere blir rSNA og jo mindre drastiske forhold som kreves for at den skal skje. Tenk på følgende eksempel representert i bildet nedenfor:
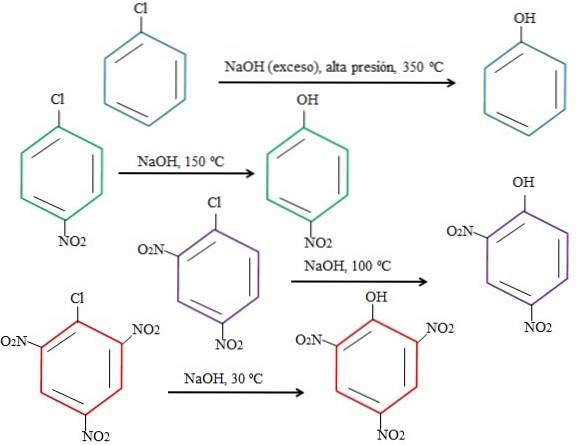
Merk at 4-nitroklorbenzen (blå ring) krever drastiske forhold (høyt trykk og en temperatur på 350 ºC) for at substitusjonen av Cl med OH skal skje. I dette tilfellet er klor den utgående gruppen (Cl-) og hydroksyd nukleofilen (OH-).
Når gruppen NO visesto, som er en elektronattraktor (grønn ring), kan substitusjonen utføres ved en temperatur på 150 ° C ved omgivelsestrykk. Når antallet NO-grupper økerto til stede (lilla og røde ringer), skjer substitusjonen ved lavere og lavere temperaturer (henholdsvis 100 ° C og 30 ° C).
Derfor er gruppene IKKEto akselerere rSNA og frata ringen av elektroner, noe som gjør den mer utsatt for OH-angrep-.
De relative posisjonene til Cl i forhold til NO vil ikke bli forklart her.to i 4-nitroklorbenzen, og hvordan disse endrer reaksjonshastigheten; For eksempel er reaksjonshastighetene til 2-nitroklorbenzen og 3-nitroklorbenzen forskjellige, sistnevnte er den tregeste sammenlignet med de andre isomerer..
Fra den utgående gruppen
Ved å ta inn 4-nitroklorbenzen er dens substitusjonsreaksjon tregere sammenlignet med dens fluorerte motstykke:
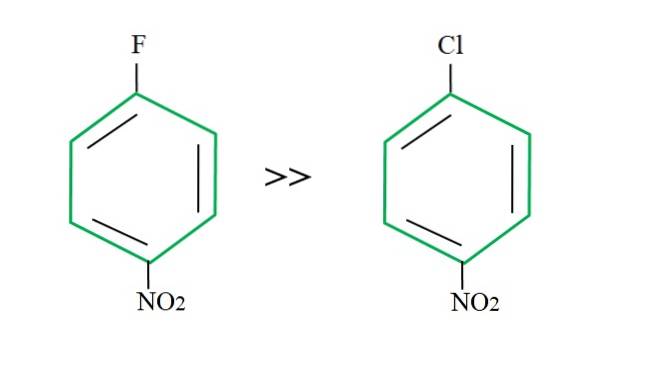
Forklaringen på dette kan ikke ligge i noen annen variabel enn forskjellen mellom F og Cl. Fluor er en forferdelig forlatende gruppe, siden CF-bindingen er vanskeligere å bryte enn C-Cl-bindingen. Derfor er brudd på denne båndet ikke det avgjørende trinnet for hastigheten for SNAr, men tillegg av Nu- til den aromatiske ringen.
Fordi fluor er mer elektronegativ enn klor, har karbonatomet knyttet til det en større elektronisk mangel (Cδ+-Fδ-). Følgelig er karbonet i CF-bindingen mye mer utsatt for å bli angrepet av Nu- enn C-Cl-obligasjonen. Det er derfor substitusjonen av F for OH er mye raskere enn den for Cl for OH.
Eksempel
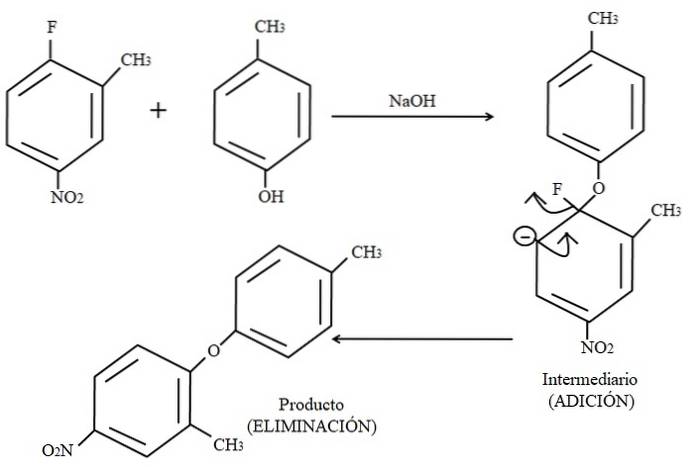
Til slutt vises et eksempel på denne typen organiske reaksjoner nedenfor på bildet ovenfor. Parakresol ser ikke ut til å være en nukleofil; men da det er et basisk medium, blir dets OH-gruppe deprotonert, og etterlater det som et fenoksidanion, som angriper 2-metyl-4-nitrofluorbenzen.
Når dette angrepet oppstår, sies det at nukleofilen tilfører elektrofilen (den aromatiske ringen av 2-metyl-4-nitrofluorbenzen). Dette trinnet kan sees på høyre side av bildet, der mellomforbindelsen dannes med begge substituenter som tilhører ringen.
Når para-kresol tilsettes, vises en negativ ladning som blir avlokalisert av resonans i ringen (merk at den slutter å være aromatisk).
Bare den siste resonansstrukturen er vist i bildet, hvorfra fluor ender som F-; men i virkeligheten blir den negative ladningen avlokalisert selv i oksygenatomene til NO-gruppento. Etter tilsetningstrinnet kommer elimineringstrinnet, det siste, det er når produktet endelig blir dannet.
Endelig kommentar
Gruppen NOto rest kan reduseres til NH-gruppento, og derfra er det mulig å utføre flere syntesereaksjoner for å modifisere det endelige molekylet. Dette fremhever det syntetiske potensialet til rSNA, og at mekanismen også består av to trinn: ett for tillegg og det andre for eliminering..
For tiden er det imidlertid eksperimentelle og beregningsmessige bevis for at reaksjonen faktisk fortsetter i henhold til en samordnet mekanisme, hvor begge trinnene skjer samtidig gjennom et aktivert kompleks og ikke et mellomprodukt..
Referanser
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10. utgave.). Wiley pluss.
- Wikipedia. (2019). Nukleofil aromatisk erstatning. Gjenopprettet fra: en.wikipedia.org
- James Ashenhurst. (6. september 2019). Nukleofil aromatisk erstatning (NAS). Gjenopprettet fra: masterorganicchemistry.com
- Kjemi LibreTexts. (5. juni 2019). Nukleofil aromatisk erstatning. Gjenopprettet fra: chem.libretexts.org


Ingen har kommentert denne artikkelen ennå.