
Faust teknikk fundament og materialer, trinn, fordeler, ulemper
De Faust teknikk Det er en metodikk som gjør det mulig å konsentrere noen parasittegg og / eller larver i avføringen ved flotasjon. Den brukes når direkte avføringstester er negative, eller når du ønsker å skaffe rene prøver uten avgift.
Konsentrasjonsmetoder for koproparasitologiske undersøkelser er av tre typer: ved flotasjon, ved sedimentering eller ved metoder som kombinerer de to foregående. Disse metodene øker sjansene for positive resultater.

Faust-metoden består i å blande en del av avføringsprøven med et stoff som er tettere enn eggene eller parasittene som skal konsentreres. Dette fører til at de, når de er mindre tette, flyter på overflaten. Supernatantvæsken blir samlet og sett under et mikroskop for identifikasjon og kvantifisering..
Denne metoden brukes til å visualisere helminth egg. I sin tur har det vist seg å være en veldig sensitiv metode for diagnostisering av Giardia lamblia, en flagellert protozoan bredt spredt over hele verden. Flotasjonsmetoder anbefales ikke for veldig tunge parasittegg som bendelorm og trematoder..
Parasitter er en av de mest utbredte tarminfeksjonene over hele verden, spesielt i fattige land med dårlige sanitærtiltak. Av denne grunn er det veldig nyttig å ha sensitive metoder som tillater identifisering og kvantifisering av disse parasittene for diagnose og behandling..
Artikkelindeks
- 1 Fundament og materialer
- 1.1 Materialer
- 2 trinn
- 2.1 Makroskopisk og mikroskopisk undersøkelse
- 2.2 Original Faust-teknikk
- 2.3 Faustteknikk ved sentrifugering
- 3 fordeler
- 4 Ulemper
- 5 Referanser
Fundament og materialer
Teknikken er basert på eksistensen av de forskjellige spesifikke gravitasjonene til egg, parasitter, cyster, larver og detritus, ved å bruke sinksulfatløsninger som en flotasjonsmetode..
Begrunnelsen for teknikken er å blande prøven med en sinksulfatoppløsning som har høyere tetthet enn lettere egg, larver eller parasitter..
Dette gjør at de tyngste elementene kan utfelle og de lettere å flyte som vises i supernatanten etter sentrifugering av prøvene..
Materialer
- Forbered en sinksulfatløsning med en tetthet på 1,18 eller 1,2 g / ml hvis prøven tidligere ble behandlet.
- Klargjør et stativ med tidligere merkede prøverør.
- Ha en sentrifugalmaskin.
- Ha objektglass og dekkglass tilgjengelig. Alle må være merket
- Sikre tilgjengeligheten av en Lugols løsning for å flekke arkene.
- Har gasbind for å filtrere.
- Ha trakter og destillert vann.
- Finn merkede plast- eller pappbeholdere.
- Også applikatorer og sterilt håndtak på 5 mm.
- En lighter for å sterilisere håndtaket.
Fremgangsmåte
Makroskopisk og mikroskopisk undersøkelse
For enhver avføringundersøkelse begynner undersøkelsen med det som kalles "makroskopisk undersøkelse" av prøvene..
Konsistensen, fargen, tilstedeværelsen av det som ser ut til å være blod, tilstedeværelsen av slim og tilstedeværelsen av voksne parasitter er beskrevet..
Så fortsetter vi til "mikroskopisk undersøkelse" av avføringen, dette avhenger av metoden. Den enkleste er metoden med direkte smøring, som er den enkleste mikroskopiske observasjonsmetoden for parasitter..
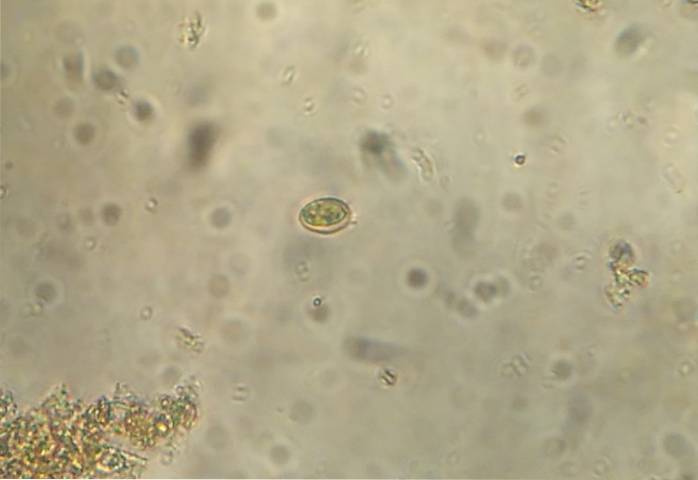
Fremgangsmåten innebærer å plassere en liten mengde av prøven direkte på et lysbilde. Plasser flere dråper saltløsning som skal være lik prøven. Bland saltløsningen med avføringen til en homogen blanding dannes. Plasser et dekkglass og undersøk under mikroskopet.
Original Faust-teknikk
Den andre prosedyren består av Faust-flotasjonsmetoden, hvis opprinnelige versjon består av:
1- Plasser omtrent to gram avføring i en egnet beholder for dette formålet.
2- Tilsett 30 ml sinksulfatflotasjonsoppløsning som det dannes en emulsjon ved å blande løsningen med avføring.
3- Sil med en metallfilter i en annen beholder og overfør til et prøverør.
4- Tilsett mer flyteoppløsning til en menisk dannes i røret.
5- Plasser et glass dekkglass på menisken. La den hvile i 10 til 15 minutter.
6- Fjern dekkglasset og legg det på et lysbilde som vil bli undersøkt under mikroskopet.
Faust-teknikk ved sentrifugering
Opprinnelig brukte metoden ikke sentrifugering, men den er nå inkludert da bedre resultater oppnås. Teknikken innebærer en rekke trinn for å oppnå en riktig prosedyre, disse er som følger:
1- Avføringen vaskes med vann, blandes godt og filtreres deretter med gasbind brettet i fire. Prøven plasseres i et prøverør.
2- Sentrifuger og fjern supernatanten (prøver som holdes over vann). Trinn 1 og 2 gjentas til supernatanten er "klar".
3- Sinksulfat tilsettes den filtrerte og sentrifugerte prøven.
4- Blandes godt.
5- Sentrifuger igjen i 1 minutt ved 2500 rpm (omdreininger per minutt).
6- Supernatanten utvinnes med en steril sløyfe på ca. 5 mm; rørene skal ikke ristes.
7- Prøven som er gjenvunnet fra supernatanten plasseres på et lysbilde og en dråpe Lugol kan plasseres for å fargelegge, dekkglasset plasseres og observeres under mikroskopet.
8- Beholderne og reagensglassene er merket.
Fordel
- Elementene som brukes til diagnosen kan observeres rene og uten "detritus", dette letter observasjonen av arket og reduserer tiden som brukes til diagnosen..
- I supernatanten utvinnes både larver, egg og / eller cyster.
- Det er en veldig billig metode.
- Fremgangsmåten er veldig enkel og enkel å implementere.
- Diagnosen er rask og nøyaktig.
- På grunn av viktigheten og den høye forekomsten av parasitose i fattige land, er disse billige og brukervennlige metodene ideelle for diagnostisering og overvåking av disse patologiene..
Ulemper
Tettheten til flotasjonsløsningen gir en sammentrekning av larvene, det vil si at de krymper og i løpet av en veldig kort periode kan deformeres. Dette tvinger undersøkeren til å stille diagnosen umiddelbart, og de behandlede prøvene kan ikke oppbevares for fremtidige undersøkelser..
Som med alle mikroskopiske identifikasjonsmetoder, tar det et høyt erfarent undersøkelsespersonell å stille nøyaktige diagnoser..
Den raske deformasjonen av elementene som er nødvendige for diagnosen, selv om de er en åpenbar ulempe, kan korrigeres ved å gjøre øyeblikkelige mikroskopiske observasjoner.
Referanser
- Ananias, F. L. (2017). Evaluering av følsomheten til Faust-metoden og spontan sedimentering for diagnostisering av giardiasis. Cuban Journal of Tropical Medicine, 68(to).
- Bartlett, M. S., Harper, K., Smith, N., Verbanac, P., & Smith, J. W. (1978). Sammenligningsevaluering av en modifisert sinksulfatflotasjonsteknikk. Tidsskrift for klinisk mikrobiologi, 7(6), 524-528.
- Becker, A. C., Kraemer, A., Epe, C., & Strube, C. (2016). Følsomhet og effektivitet av utvalgte koproskopiske metoder - sedimentering, kombinert sinksulfatsedimentering-flotasjon og McMaster-metoden. Parasitologiforskning, 115(7), 2581-2587.
- Garcia, L. S., Arrowood, M., Kokoskin, E., Paltridge, G. P., Pillai, D. R., Procop, G. W.,… & Visvesvara, G. (2018). Laboratoriediagnose av parasitter fra mage-tarmkanalen. Kliniske mikrobiologiske vurderinger, 31(1), e00025-17.
- Summers, W. A. (1942). En modifisering av sinksulfat sentrifugal flotasjonsmetode for utvinning av helminth egg i formalinisert avføring. Journal of Parasitology, 28(4), 345-346.


Ingen har kommentert denne artikkelen ennå.