
Carbon tetrachloride (CCl4) struktur, egenskaper, bruksområder
De Karbontetraklorid det er en fargeløs væske, med en litt søt lukt, som ligner lukten av eter og kloroform. Den kjemiske formelen er CCl4, og den utgjør en kovalent og flyktig forbindelse, hvis damp har større tetthet enn luft; den er ikke en leder av elektrisitet og er heller ikke brennbar.
Den finnes i atmosfæren, elvevannet, havet og sedimentene på den marine overflaten. Karbontetraklorid som er tilstede i røde alger antas å være syntetisert av den samme organismen.
I atmosfæren produseres det ved omsetning av klor og metan. Industrielt produsert karbontetraklorid kommer ut i havet, hovedsakelig gjennom grensesnittet mellom sjø og luft. Dens atmosfæriske strømning => oceaniske er estimert til å være 1,4 x 1010 g / år, tilsvarende 30% av det totale karbontetraklorid i atmosfæren.
Artikkelindeks
- 1 Hovedtrekk
- 2 Struktur
- 3 Fysiske og kjemiske egenskaper
- 4 bruksområder
- 4.1 Kjemisk produksjon
- 4.2 Produksjon av kjølemedier
- 4.3 Brannslukking
- 4.4 Rengjøring
- 4.5 Kjemisk analyse
- 4.6 Infrarød spektroskopi og kjernemagnetisk resonans
- 4.7 Løsemiddel
- 4.8 Andre bruksområder
- 5 Toksisitet
- 5.1 Hepatotoksiske mekanismer
- 5.2 Giftige effekter på nyre- og sentralnervesystemet
- 5.3 Effekter av eksponering hos mennesker
- 5.4 Giftige interaksjoner
- 6 Intermolekylære interaksjoner
- 7 Referanser
Hovedtrekkene
Karbontetraklorid produseres industrielt ved termisk klorering av metan, og reagerer metan med klorgass ved en temperatur mellom 400 ° C og 430 ° C. Under reaksjonen genereres et råprodukt med et biprodukt av saltsyre.
Den produseres også industrielt ved hjelp av karbondisulfidmetoden. Klor og karbondisulfid reageres ved en temperatur på 90 ° C til 100 ° C ved bruk av jern som katalysator. Deretter utsettes råproduktet for fraksjonering, nøytralisering og destillasjon.
CCl4 Det har hatt flere bruksområder, blant annet: løsemiddel for fett, oljer, lakk, osv. klesrens; plantevernmidler, røyking og soppdrepende midler og produksjon av nylon. Imidlertid, til tross for sin store nytte, har bruken blitt delvis kastet på grunn av den høye toksisiteten den gir..
Hos mennesker genererer det toksiske effekter på hud, øyne og luftveier. Men de mest skadelige effektene oppstår på funksjonen til sentralnervesystemet, leveren og nyrene. Nyreskade er kanskje den viktigste dødsårsaken tilskrevet den giftige virkningen av karbontetraklorid.
Struktur
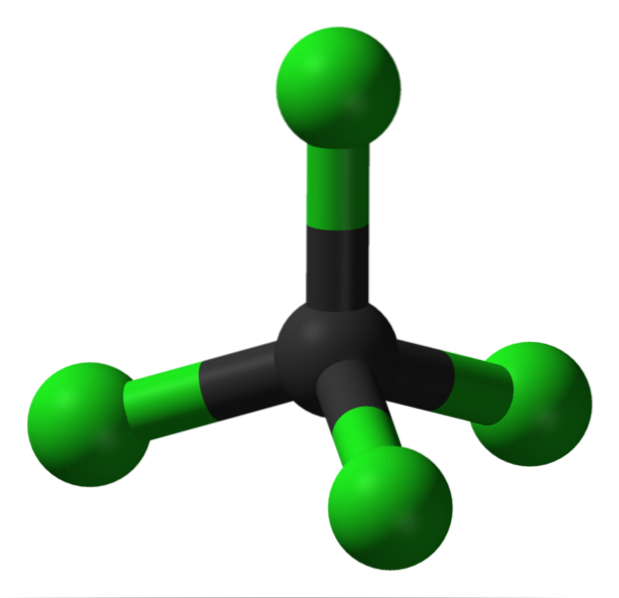
På bildet kan du se strukturen til karbontetraklorid, som har tetrahedral geometri. Merk at Cl-atomene (de grønne kulene) er orientert i rommet rundt karbonet (svart kule) og tegner en tetraeder.
På samme måte bør det nevnes at siden alle toppunktene i tetraeder er identiske, er strukturen symmetrisk; det vil si uansett hvordan CCl-molekylet roteres4, det vil alltid være det samme. Så, siden den grønne tetraeder av CCl4 er symmetrisk, resulterer det i fravær av et permanent dipolmoment.
Hvorfor? Fordi selv om C-Cl-bindingene har polær karakter på grunn av den større elektronegativiteten til Cl med hensyn til C, avbrytes disse øyeblikkene vectorly. Derfor er det en apolar klorert organisk forbindelse..
Karbon kloreres fullstendig i CCl4, som er lik høy oksidasjon (karbon kan danne maksimalt fire bindinger med klor). Dette løsningsmidlet har ikke en tendens til å miste elektroner, er aprotisk (har ikke hydrogener) og representerer et lite transportmiddel og lagring av klor..
Fysiske og kjemiske egenskaper
Formel
CCl4
Molekylær vekt
153,81 g / mol.
Fysisk utseende
Det er en fargeløs væske. Krystalliserer i form av monokliniske krystaller.
Lukt
Den har den karakteristiske lukten som er tilstede i andre klorerte løsningsmidler. Lukten er aromatisk og noe søt, ligner lukten av tetrakloretylen og kloroform.
Kokepunkt
76,8 ° C ved 760 mmHg.
Smeltepunkt
-9 ° F (-23 ° C).
Vannløselighet
Det er lite løselig i vann: 1,16 mg / ml ved 25 ºC og 0,8 mg / ml ved 20 ºC. Hvorfor? Fordi vann, et høyt polært molekyl, ikke "føler" affinitet for karbontetraklorid, som er ikke-polært..
Løselighet i organiske løsningsmidler
På grunn av symmetrien til dens molekylære struktur er karbontetraklorid en ikke-polær forbindelse. Derfor er det blandbart med alkohol, benzen, kloroform, eter, karbondisulfid, petroleumeter og nafta. På samme måte er det løselig i etanol og aceton..
Tetthet
I flytende tilstand: 1,59 g / ml ved 68 º F og 1,594 g / ml ved 20 ºC.
I fast tilstand: 1,831 g / ml ved -186 ºC og 1,809 g / ml ved -80 ºC.
Stabilitet
Generelt inert.
Etsende handling
Angriper noen former for plast, gummi og belegg.
antennelsespunkt
Det betraktes som lite brannfarlig, noe som indikerer at antennelsespunktet er under 982 ºC.
Selvantennelse
982 ºC (1800 º F, 1255 K).
Damptetthet
5.32 i forhold til luft, tatt som en referanseverdi lik 1.
Damptrykk
91 mmHg ved 68 ° F; 113 mmHg ved 77 ° F og 115 mmHg ved 25 ° C.
Nedbrytning
I nærvær av brann danner det klorid og fosgen, en svært giftig forbindelse. På samme måte nedbrytes den under samme betingelser til hydrogenklorid og karbonmonoksid. I nærvær av vann ved høye temperaturer kan det forårsake saltsyre.
Viskositet
2,03 x 10-3 Pa s
Luktterskel
21,4 spm.
Brytningsindeks (ηD)
1.4607.
applikasjoner
Kjemisk produksjon
-Det griper inn som et kloreringsmiddel og / eller løsemiddel ved fremstilling av organisk klor. På samme måte griper den inn som en monomer i produksjonen av Nylon..
-Fungerer som løsemiddel ved fremstilling av gummisement, såpe og insektmiddel.
-Den brukes til fremstilling av drivstoffet klorfluorkarbon.
-Da det ikke har C-H-bindinger, gjennomgår ikke karbontetraklorid reaksjoner med frie radikaler, noe som gjør det til et nyttig løsningsmiddel for halogeneringer, enten ved hjelp av et elementært halogen eller ved et halogeneringsreagens, slik som N-bromsuccinimid..
Produksjon av kjølemiddel
Den ble brukt i produksjonen av klorfluorkarbon, kjølemiddel R-11 og triklorfluormetan, kjølemiddel R-12. Disse kjølemediene ødelegger ozonlaget, og det er derfor bruken av dem ble anbefalt å opphøre, i samsvar med anbefalingene i Montreal-protokollen..
Branndemping
På begynnelsen av 1900-tallet begynte karbontetraklorid å bli brukt som brannslukker, basert på et sett med egenskaper til forbindelsen: den er flyktig; dens damp er tyngre enn luft; det er ikke en elektrisk leder og er ikke veldig brannfarlig.
Når karbontetraklorid blir oppvarmet, blir det til en tung damp som dekker forbrenningsproduktene, isolerer dem fra oksygenet som er tilstede i luften og får brannen til å slukke. Den er egnet for å bekjempe olje og apparatbranner.
Imidlertid kan karbontetraklorid reagere med vann ved temperaturer over 500 ºC og forårsake fosgen, en giftig forbindelse, så ventilasjon må tas hensyn til under bruk. I tillegg kan det reagere eksplosivt med metallisk natrium, og bruk av det i branner med nærvær av dette metallet bør unngås..
Rengjøring
Karbontetraklorid har lenge vært brukt i renseri av klær og andre husholdningsmaterialer. I tillegg brukes den som et industrielt metallavfettingsmiddel, utmerket for oppløsning av fett og olje.
Kjemisk analyse
Brukes til påvisning av bor, bromid, klorid, molybden, wolfram, vanadium, fosfor og sølv.
Infrarød spektroskopi og kjernemagnetisk resonans
-Det brukes som løsemiddel i infrarød spektroskopi, siden karbontetraklorid ikke har en signifikant absorpsjon i bånd> 1600 cm-1.
-Det ble brukt som løsningsmiddel i kjernemagnetisk resonans, siden det ikke forstyrret teknikken, da det ikke hadde hydrogen (det er aprotisk). Men på grunn av dets toksisitet, og den lave løsningsmiddelkraften, har karbontetraklorid blitt erstattet av deutererte løsemidler..
Løsemiddel
Karakteristikken ved å være en ikke-polær forbindelse tillater bruk av karbontetraklorid som et løsningsmiddel for oljer, fett, lakk, lakk, gummivoks og harpiks. Det kan også oppløse jod.
Andre bruksområder
-Det er en viktig komponent i lavalamper, siden karbontetraklorid tilfører vekt til voks på grunn av dens tetthet..
-Brukes av frimerkesamlere da den avslører vannmerker på frimerker uten å forårsake skade.
-Det har blitt brukt som et pesticid- og soppdrepende middel og ved gassing av korn for å eliminere insekter..
-I metallskjæringsprosessen brukes det som smøremiddel.
-Det har blitt brukt i veterinærmedisin som et anthelmintikum i behandlingen av fasciolasis, forårsaket av Fasciola hepatica hos sau..
Toksisitet
-Karbontetraklorid kan absorberes gjennom luftveiene, fordøyelsessystemet, øynene og huden. Svelging og innånding er veldig farlig, da de kan forårsake alvorlig langvarig skade på hjerne, lever og nyrer..
-Kontakt med huden forårsaker irritasjon og kan på lang sikt forårsake dermatitt. Mens kontakt med øynene forårsaker irritasjon.
Hepatotoksiske mekanismer
De viktigste mekanismene som produserer leverskade er oksidativt stress og endring av kalsiumhomeostase.
Oksidativt stress er en ubalanse mellom produksjonen av reaktive oksygenarter og kroppens evne til å generere et reduserende miljø i cellene som styrer oksidative prosesser..
Ubalansen i normal redoks-tilstand kan forårsake toksiske effekter på grunn av produksjon av peroksider og frie radikaler som skader alle komponentene i cellene..
Karbontetraklorid metaboliseres og produserer frie radikaler: Cl3C. (triklormetylradikal) og Cl3COO. (triklormetylperoksydradikal). Disse frie radikaler produserer lipoperoksidering, som forårsaker skade på leveren og også lungene.
Frie radikaler forårsaker også nedbrytning av plasmamembranen i leverceller. Dette gir en økning i den cytosoliske kalsiumkonsentrasjonen og en reduksjon i den intracellulære mekanismen for kalsiumbinding..
Økt intracellulært kalsium aktiverer enzymet fosfolipase A.to som virker på fosfolipider i membranen og forverrer dens påvirkning. I tillegg er det nøytrofil infiltrasjon og hepatocellulær skade. Det er en reduksjon i mobilkonsentrasjonen av ATP og glutation som forårsaker enzyminaktivering og celledød.
Giftige effekter på nyresystemet og sentralnervesystemet
De toksiske effektene av karbontetraklorid manifesteres i nyresystemet med en reduksjon i produksjonen av urin og kroppens akkumulering av vann. Spesielt i lungene og en økning i konsentrasjonen av metabolsk avfall i blodet. Dette kan føre til død.
På nivået av sentralnervesystemet er det involvering av aksonal ledning av nerveimpulser.
Effekter av eksponering hos mennesker
Kort varighet
Øyeirritasjon; effekter på lever, nyre og sentralnervesystemet, noe som kan føre til tap av bevissthet.
Lang varighet
Dermatitt og mulig kreftfremkallende virkning.
Giftige interaksjoner
Det er en sammenheng mellom mange av tilfellene av karbontetrakloridforgiftning og alkoholbruk. Overdreven alkoholinntak forårsaker leverskade, i noen tilfeller forårsaker levercirrhose.
Toksisiteten til karbontetraklorid har blitt observert økt med barbiturater, da de har noen lignende toksiske effekter..
For eksempel, på nyrenivå, reduserer barbiturater urinutskillelsen, og denne effekten av barbiturater ligner den toksiske effekten av karbontetraklorid på nyrefunksjonen..
Intermolekylære interaksjoner
CCl4 det kan betraktes som et grønt tetraeder. Hvordan samhandler du med andre?
Å være et apolært molekyl uten permanent dipolmoment, kan det ikke samhandle gjennom dipol-dipolkrefter. For å holde molekylene sammen i væsken, må kloratomene (tetraederens toppunkt) samhandle med hverandre på en eller annen måte; og de gjør det takket være spredningsstyrkene i London.
De elektroniske skyene av Cl-atomer beveger seg, og genererer i korte øyeblikk områder som er rike og fattige av elektroner; det vil si at de genererer øyeblikkelige dipoler.
Den δ- elektronrike sonen får Cl-atomet i et nabomolekyl til å polarisere: Clδ- δ+Cl. Dermed kan to atomer av Cl holdes sammen i en begrenset periode..
Men siden det er millioner av CCl-molekyler4, interaksjonene blir effektive nok til å danne en væske under normale forhold.
Videre øker de fire Cl kovalent bundet til hver C antallet av disse interaksjonene betydelig; så mye at det koker ved 76,8 ºC, et høyt kokepunkt.
Kokepunktet til CCl4 det kan ikke være høyere fordi tetraeder er relativt små sammenlignet med andre apolære forbindelser (som xylen, som koker ved 144 ° C).
Referanser
- Hardinger A. Steven. (2017). Illustrert ordliste for organisk kjemi: karbontetraklorid. Gjenopprettet fra: chem.ucla.edu
- Hele Siyavula. (s.f.). Intermolekylære og interatomære krefter. Gjenopprettet fra: siyavula.com
- Carey F. A. (2006). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Wikipedia. (2018). Karbontetraklorid. Gjenopprettet fra: en.wikipedia.org
- PubChem. (2018). Karbontetraklorid. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Kjemisk bok. (2017). Karbontetraklorid. Gjenopprettet fra: chemicalbook.com


Ingen har kommentert denne artikkelen ennå.