
Spore flekker begrunnelse, teknikker og bruksområder

De sporeflekker Det er metoden som brukes til å fargelegge motstandsstrukturene som danner noen bakterieslekt når de er i ugunstige forhold; disse strukturene tilsvarer en form for overlevelse.
Det er mange slekter som danner sporer; de viktigste er imidlertid Bacillus og Clostridium. Disse slektene anses å være mer relevante fordi de har arter som er patogene for mennesker..
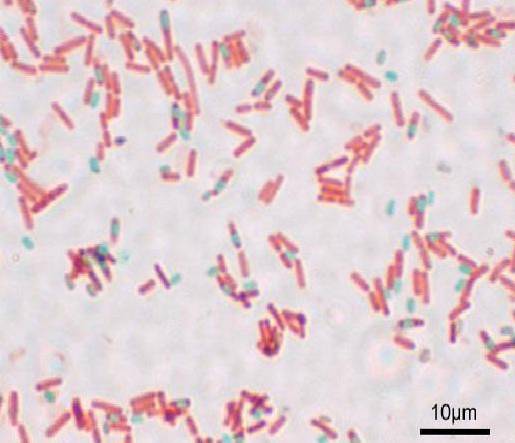
Hver basille kan gi spor. På tidspunktet for farging av preparatet, kan sporen bli funnet i basillen (endosporen) eller utenfor den (exospore). Med konvensjonelle fargeteknikker for bakterier - slik som Gram-flekken - forblir sporene fargeløse.
Foreløpig er det flere fargemetoder som er i stand til å trenge gjennom den tykke strukturen i sporen for å fargelegge den. Disse metodene er veldig varierte; Disse inkluderer Dorner-teknikken, Möeller-flekken og Shaeffer-Fulton-metoden, også kjent som Wirtz-Conklin..
Av alle nevnte teknikker er Shaeffer-Fulton-metoden den mest brukte i rutinelaboratorier. Den er oppkalt etter to mikrobiologer som opprettet fargen i 1930: Alicia Shaeffer og MacDonald Fulton. Imidlertid kalles teknikken noen ganger Wirtz-Conklin til ære for to bakteriologer fra 1900-tallet..
Artikkelindeks
- 1 Begrunnelse
- 2 Sporfargingsteknikker
- 2.1 Dorner-teknikk
- 2.2 Modifisert Dorner-teknikk
- 2.3 Shaeffer-Fulton eller Wirtz-Conklin teknikk
- 2.4 Möeller teknikk
- 2.5 Modifisert Möeller-teknikk uten varme
- 3 bruksområder
- 3.1 Eksempler
- 4 Referanser
Basis
Sporene flekker ikke med konvensjonelle flekker fordi de har en veldig tykk vegg. Den komplekse sammensetningen av sporene forhindrer at de fleste fargestoffer kommer inn.
Hvis sporen studeres utenfra og inn, observeres følgende lag: først er exosporium, som er det tynneste og ytre laget dannet av glykoproteiner.
Deretter kommer skjellaget, som gir motstand mot høye temperaturer, etterfulgt av hjernebarken som består av peptidoglykan. Senere er veggen på basen som beskytter protoplasten.
Sporen er en dehydrert struktur som inneholder 15% kalsium og dipikolinsyre. Av denne grunn er de fleste sporefargingsteknikker avhengige av påføring av varme slik at fargestoffet kan trenge gjennom den tykke strukturen..
Når sporen er farget, kan den ikke fjerne fargestoffet. I Shaeffer-Fulton-teknikken kommer malakittgrønt inn i vegetative celler, og når det påføres varme, trenger det også inn i endosporen og exosporene..
Ved å vaske med vann fjernes fargestoffet fra den vegetative cellen. Dette skjer fordi malakittgrønt fargestoff er litt grunnleggende, så det binder seg svakt til den vegetative cellen..
I stedet kan den ikke komme ut av sporen, og basillen blir til slutt motfarget med safranin. Dette grunnlaget er gyldig for resten av teknikkene, der noe lignende skjer.
Spore flekker teknikker
For å utføre sporefarging, må du ha en ren kultur av den mistenkelige belastningen du vil studere..
Kulturen utsettes for ekstreme temperaturer i 24 timer for å stimulere mikroorganismen til å sporulere. For dette kan kulturen plasseres i en ovn ved 44 ° C eller i kjøleskap (8 ° C) i 24 eller 48 timer..
Hvis de blir for lenge ved de nevnte temperaturene, vil bare eksosporer bli observert, siden alle endosporer allerede har forlatt basillen.
På slutten av tiden bør noen dråper steril fysiologisk løsning plasseres på et rent lysbilde. Deretter tas en liten del av kulturen, og det lages en fin spredning.
Den blir deretter tørket, satt i varmen og farget med en av teknikkene som er forklart nedenfor:
Dorner-teknikk
1 - Forbered en konsentrert suspensjon av den sporulerte mikroorganismen i destillert vann i et reagensrør og tilsett et like volum filtrert Kinyoun carbol fuchsin.
2- Plasser røret i et kokende vannbad i 5 til 10 minutter.
3- På et rent lysbilde blandes en dråpe av den forrige suspensjonen med en dråpe av en 10% vandig løsning av nigrosin, kokt og filtrert..
4- Spred og tørk raskt med mild varme.
5- Undersøk med et 100X-mål (nedsenking).
Sporer flekker røde og bakterieceller virker nesten fargeløse mot en mørk grå bakgrunn.
Modifisert Dorner-teknikk
1 - En suspensjon av den sporulerte mikroorganismen blir spredt på et lysbilde og festet i varmen.
2- Prøven er dekket med en filterpapirstrimmel som karbolisk fuchsin tilsettes. Fargestoffet varmes opp i 5 til 7 minutter med flammen til Bunsen-brenneren til utviklingen av damp dannes. Deretter fjernes papiret.
3- Preparatet vaskes med vann og tørkes deretter med absorberende papir.
4- Dekk utstrykingen med en tynn film med 10% nigrosin, ved å bruke et annet lysbilde for å spre nigrosinet eller en nål.
Fargen som sporer og bakterier tar er den samme som beskrevet i kjent teknikk.
Shaeffer-Fulton eller Wirtz-Conklin teknikk
1- Lag et fint utstryk med en suspensjon av den sporulerte mikroorganismen på et lysbilde og fest til varme.
2- Dekk lysbildet med 5% malakittgrønn vandig løsning (et filterpapir kan legges på lysbildet).
3- Varm opp over flammen til Bunsen-brenneren for å forårsake utslipp av damp og fjern flammen. Gjenta operasjonen i 6 til 10 minutter. Hvis den malakittgrønne løsningen fordamper for mye under prosedyren, mer.
4- Fjern filterpapiret (hvis det er installert) og vask med vann.
5- Dekk lysbildet med 0,5% vandig safranin i 30 sekunder (noen varianter av teknikken bruker 0,1% vandig safranin og la den stå i 3 minutter).
Med denne teknikken fremstår sporene som grønne og basillene røde..
Det har ulempen at endosporene til unge kulturer ikke flekker bra, siden de virker ekstremt klare eller fargeløse. For å unngå dette anbefales det å bruke kulturer med 48 timers inkubasjon..
Möeller teknikk
1- Dekk utstrykingen med kloroform i 2 minutter.
2- Kast kloroformen.
3- Dekk til med 5% kromsyre i 5 minutter.
4- Vask med destillert vann
5- Lakenet er dekket med carbol fuchsin-fenicada og utsatt for flammen til Bunsen-brenneren til utslipp av damp; så blir den fjernet fra flammen i noen øyeblikk. Operasjonen gjentas til 10 minutter er fullført.
6- Vask med vann.
7- Bruk forsuret etanol (saltsprit) for å misfarge. La stå i 20 eller 30 sekunder.
8- Vask med destillert vann.
9- Kontraster ved å dekke arket med metylenblått i 5 minutter.
10- Vask med destillert vann.
11- La den tørke og ta prøven til mikroskopet.
Sporene virker røde og basillene blå. Det er viktig å ikke puste inn damper, da de er giftige og på lang sikt kan være kreftfremkallende..
Varmeløs modifisert Möeller-teknikk
I 2007 opprettet Hayama og hans samarbeidspartnere en modifisering av Möeller-teknikken. De eliminerte trinnet med oppvarming av fargestoffet og erstattet det ved å tilsette 2 dråper overflateaktivt middel Tergitol 7 for hver 10 ml carbol-fuchsin-carbol-løsning. De samme resultatene ble oppnådd.
applikasjoner
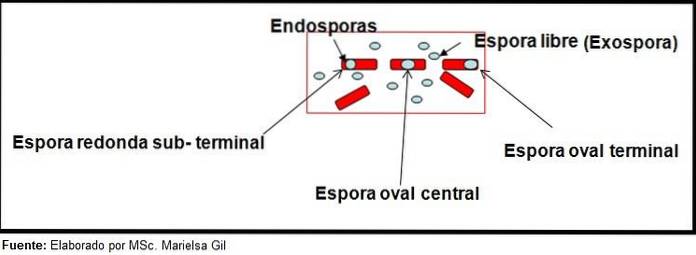
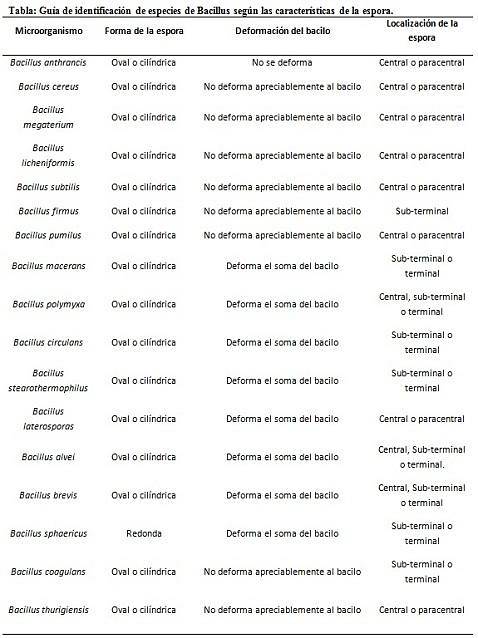
Farging av sporer gir meget verdifull og nyttig informasjon for identifisering av patogenet, siden dets tilstedeværelse, dens form, plassering i basillen og evnen til å deformere den vegetative cellen eller ikke, er data som kan lede arten. Involvert i en bestemt sjanger.
I denne sammenhengen er det verdt å si at sporene kan være runde eller ovale, de kan være plassert i sentrum eller også i en paracentral, subminal eller terminal posisjon..
Eksempler
- Clostridium difficile danner en oval spore i terminal posisjon som deformerer basillen.
- Sporen av Clostridium tertium den er oval, deformerer ikke basillen og ligger på terminalnivå.
- Endosporen til Clostridium tetani er terminal og deformerer basillen og gir utseendet til en trommestokk.
- Sporer av Clostridium botulinum, C. histolyticum, C. nybegynner Y C. septicum de er runde eller ovale underterminaler og deformerer basillen.
- Endosporen til Clostridium sordelli ligger sentralt, med en liten deformasjon.
Referanser
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Forslag om en forenklet teknikk for farging av bakteriesporer uten å anvende varmesuksessfull modifisering av Moellers metode. Eur J Med Res. 2007; 16 12 (8): 356-9.
- Wikipedia-bidragsytere. Moeller flekk. Wikipedia, The Free Encyclopedia. 3. november 2018, 03:28 UTC. Tilgjengelig på: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Laboratoriehåndbok for mikrobiologiske teknikker. Institutt for grunnleggende vitenskapsakademi for mikrobiologi. Nasjonalt polyteknisk institutt.
- "Endospore." Wikipedia, The Free Encyclopedia. 25. februar 2018, 10:20 UTC. 10. jan 2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J og samarbeidspartnere. (2006). Arbeidspersonell i det autonome samfunnet Extremadura. Spesifikk agenda Volum IV. MAD redaksjonelt. Sevilla-Spania, s 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006). Laboratoriespesialisttekniker, Galisisk helsetjeneste (SERGAS). Spesifikk fagagenda bind 2. Redaksjonell MAD. Sevilla-Spania, s 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. (5. utg.). Argentina, redaksjonelt Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott mikrobiologisk diagnose. 12. utg. Argentina. Redaksjonell Panamericana S.A



Ingen har kommentert denne artikkelen ennå.