
Sodium thiosulfate (Na2S2O3) formel, egenskaper og bruksområder
De natriumtiosulfat eller natriumhyposulfitt (NatoStoELLER3) Det er et viktig uorganisk salt med forskjellige medisinske bruksområder. Det er også tilgjengelig som det pentahydrerte saltet (NatoStoELLER3.5HtoELLER).
Det er en ionisk forbindelse dannet av to natriumkationer (Na+) og den negativt ladede tiosulfatanionen (StoELLER3-), der det sentrale svovelatomet er knyttet til tre oksygenatomer og et annet svovelatom (derav prefikset onkel), gjennom enkelt- og dobbeltbindinger med resonanskarakter. Det faste stoffet eksisterer i en monoklinisk krystallstruktur.
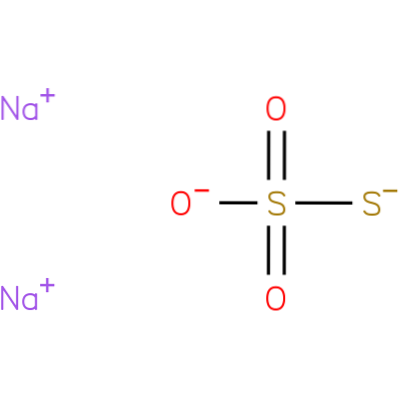
Natriumtiosulfat kan fremstilles ved oppvarming av svovel med en vandig løsning av natriumsulfitt eller en vandig løsning av natriumhydroksid..
6NaOH + 4S → NatoStoELLER3 + 2NatoS + 3HtoELLER
Det er et medikament som er på listen over viktige medisiner fra Verdens helseorganisasjon, de mest effektive og trygge medisinene som trengs i et helsesystem (Sodium Thiosulfate Formula, S.F.).
Artikkelindeks
- 1 Fysiske og kjemiske egenskaper
- 2 Reaktivitet og farer
- 3 bruksområder
- 3.1 Medisin
- 3.2 Jodometri
- 3.3 Avklorering av vann
- 3.4 Gullgruvedrift
- 4 Referanser
Fysiske og kjemiske egenskaper
Natriumtiosulfat har en molekylvekt på 158,11 g / mol for sin vannfrie form og 248,18 g / mol for pentahydratformen. I tillegg har den en tetthet på 1667 g / ml (National Center for Biotechnology Information., 2017).
Sodium thiosulfate er fargeløse monokliniske krystaller uten karakteristisk aroma. Dette faste stoffet er lysende, noe som betyr at det i seg selv kan reduseres til støv ved tap av krystallisasjonsvann når det utsettes for luft. Utseendet er vist i figur 2.

Forbindelsen har et smeltepunkt på 48 ° C for pentahydratformen og fra 100 ° C begynner den å spaltes. Deretter entoStoELLER3 Det er veldig løselig i vann, og er i stand til å oppløse 70 gram per 100 ml løsningsmiddel. Forbindelsen er praktisk talt uoppløselig i etanol (Royal Society of Chemistry, 2015).
Natriumtiosulfat er et nøytralt salt som lett dissosieres i vann for å gi natrium- og tiosulfationer. NatoStoELLER3 Det er et stabilt fast stoff under normale forhold, men brytes ned ved oppvarming for å gi natriumsulfat og natriumpolysulfid:
4NatoStoELLER3 → 3NatoSW4 + NatoS5
Det brytes også ned når det behandles med fortynnede syrer for å gi svovel og svoveldioksid (kalt klokkereaksjon):
NatoStoELLER3 + 2HCl → 2NaCl + S + SOto + HtoELLER
Reagerer støkiometrisk (i ekvimolære mengder) med vandige jodløsninger, noe som gjør det mye brukt i laboratorier for jodbaserte titreringer.
Reaktivitet og farer

Sodium thiosulfate er ikke et giftig materiale og brukes til medisinske formål. Men når det spaltes, produserer det giftig svoveloksidgass, som kan forårsake irritasjon i øynene, huden og slimhinnene..
Forbindelsen kan irritere øynene, huden og luftveiene. Stoffet er giftig for lungene og slimhinnene. Gjentatt eller langvarig eksponering for stoffet kan forårsake skade på disse organene..
Hvis stoffet kommer i kontakt med øynene, bør kontaktlinser kontrolleres og fjernes. Øyne skal skylles straks med mye vann i minst 15 minutter med kaldt vann.
Ved hudkontakt, skal det berørte området skylles straks med rikelig med vann i minst 15 minutter, mens forurensede klær og sko fjernes. Dekk irritert hud med et mykgjørende middel. Vask klær og sko før de brukes på nytt. Hvis kontakten er alvorlig, vask med desinfiserende såpe og dekk forurenset hud med en antibakteriell krem.
Ved innånding skal offeret flyttes til et kjølig sted. Hvis du ikke puster, gis kunstig åndedrett. Hvis det er vanskelig å puste, gi oksygen.
Hvis stoffet svelges, skal oppkast ikke induseres med mindre det er instruert av medisinsk personell. Løsne stramme klær som en skjortekrage, belte eller slips.
I alle tilfeller bør øyeblikkelig legehjelp innhentes. (Sikkerhetsdatablad Natriumtiosulfat vannfritt, 2013).
applikasjoner
Medisin
Natriumtiosulfat kan brukes til å redusere noen av bivirkningene av cisplatin (et kreftmedisin). Det brukes til å håndtere ekstravasasjoner under cellegift. Natriumtiosulfat forhindrer alkylering og vevsdestruksjon ved å tilveiebringe et substrat for alkyleringsmidler som har invadert subkutant vev.
Det brukes også sammen med et annet medikament i akuttbehandling av cyanidforgiftning (U.S. National Library of Medicine, S.F.).
I denne behandlingen injiseres natriumnitritt intravenøst for å produsere hemoglobin som kombineres med cyanidionet, og konverterer det midlertidig til cyanmetoglobinformen. Deretter injiseres natriumtiosulfat.
Tiosulfat fungerer som et substrat for enzymet rhodanase, som katalyserer omdannelsen av cyanid til det mye mindre giftige tiocyanatet, som skilles ut i urinen (HSDB: SODIUM THIOSULFATE, 2003).
Natriumtiosulfat brukes også som behandling for kalsifylakse hos personer i hemodialyse med nyresykdom i sluttstadiet. Det er tilsynelatende et ikke fullt forstått fenomen, hvor dette forårsaker alvorlig metabolsk acidose hos noen pasienter..
Jodometri
Natriumtiosulfat reagerer støkiometrisk med jod for å gi jod i henhold til reaksjonen:
2NatoStoELLER3 + I2 → S4ELLER62− + 2I-
Denne egenskapen gjør at forbindelsen brukes som en titreringsmiddel ved bestemmelse av jod..
Denne spesielle bruken kan etableres for å måle oksygeninnholdet i vann gjennom en lang rekke reaksjoner i Winkler-testen for oppløst oksygen..
Det brukes også i den volumetriske estimeringen av konsentrasjonene av visse forbindelser i oppløsning (hydrogenperoksid, for eksempel) og i estimeringen av klorinnholdet i kommersielt pulverisert blekemiddel og vann..
Vannavklorering
Natriumtiosulfat brukes til å avklorinere vann, inkludert å senke klornivået for bruk i akvarier og svømmebassenger og spa og i vannbehandlingsanlegg for å behandle etablert tilbakespylingsvann før det slippes ut i elvene.
Reduksjonsreaksjonen er analog med jodreduksjonsreaksjonen, tiosulfat reduserer hypokloritt (aktiv ingrediens i blekemiddel) og oksiderer derved til sulfat. Den komplette reaksjonen er:
4NaClO + NatoStoELLER3 + 2NaOH → 4NaCl + 2NatoSW4 + HtoELLER
Gull graving
Natriumtiosulfat er en komponent som brukes som et alternativt utvaskingsmiddel til cyanid for gullekstraksjon. Imidlertid danner det et sterkt løselig kompleks med gull (I) ionene, [Au (StoELLER3)to]3-.
Fordelen med denne tilnærmingen er at tiosulfat i det vesentlige er giftfri, og at mineraltyper som er ildfaste for gullcyanidering, kan utvaskes av tiosulfat (M.G Aylmore, 2001).
Referanser
- EMBL-EBI. (2016, 1. juni). natriumtiosulfat. Gjenopprettet fra ebi.ac.uk: ebi.ac.uk.
- HSDB: NATRIUMTIOSULFAT. (2003, 3. mai). Gjenopprettet fra toxnet: toxnet.nlm.nih.gov.
- G Aylmore, D. M. (2001). Tiosulfat utvasking av gull-A gjennomgang. Minerals Engineering Volume 14, Issue 2, 135-174. sciencedirect.com.
- Sikkerhetsdatablad Natriumtiosulfat vannfritt. (2013, 21. mai). Gjenopprettet fra sciencelab.com.
- Nasjonalt senter for bioteknologisk informasjon ... (2017, 18. mars). PubChem Compound Database; CID = 24477. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Natriumtiosulfat. Gjenopprettet fra chemspider.com.
- Sodium Thiosulfate Formula. (S.F.). Gjenopprettet fra softschools: softschools.com.
- S. National Library of Medicine. (S.F.). Sodium Thiosulfate (i en vene). Gjenopprettet fra ncbi.nlm.nih.gov.



Ingen har kommentert denne artikkelen ennå.