
Wolframhistorie, egenskaper, struktur, bruksområder
De wolfram, wolfram eller wolfram er et tungt overgangsmetall hvis kjemiske symbol er W. Det ligger i periode 6 med gruppe 6 i det periodiske systemet, og atomnummeret er 74. Navnet har to etymologiske betydninger: hardstein og ulveskum; av det andre er fordi dette metallet også er kjent som wolfram.
Det er et sølvgrått metall, og selv om det er sprøtt, har det stor hardhet, tetthet og høye smelte- og kokepunkter. Derfor har den blitt brukt i alle de applikasjonene som involverer høye temperaturer, trykk eller mekaniske krefter, så som bor, prosjektiler eller strålingsemitterende filamenter..

Den mest kjente bruken av dette metallet, på kulturelt og populært nivå, er i glødetrådene til elektriske pærer. Den som har manipulert dem, vil innse hvor skjøre de er; de er imidlertid ikke laget av ren wolfram, som er smidig og duktil. I tillegg gir det i metalliske matriser som legeringer utmerket motstand og hardhet.
Det er preget og preget av å være metallet med høyest smeltepunkt, og også ved å være tettere enn bly i seg selv, bare overgått av andre metaller som osmium og iridium. Det er også det tyngste metallet som er kjent for å spille en biologisk rolle i kroppen..
Wolframatanionet, WO4to-, som kan polymerisere for å danne klynger i et surt medium. På den annen side kan wolfram danne intermetalliske forbindelser, eller sintres med metaller eller uorganiske salter, slik at dets faste stoffer får forskjellige former eller konsistenser..
Det er ikke veldig rikelig i jordskorpen, med bare 1,5 gram av dette metallet per tonn. Dessuten, da det er et tungt element, er dets opprinnelse intergalaktisk; spesielt fra supernovaeksplosjoner, som må ha kastet "jetfly" av wolframatomer mot planeten vår under dannelsen.
Artikkelindeks
- 1 Historie
- 1.1 Etymologi
- 1.2 Anerkjennelse og oppdagelse
- 1.3 Stål og pærer
- 2 eiendommer
- 2.1 Fysisk utseende
- 2.2 Atomnummer
- 2.3 Molar masse
- 2.4 Smeltepunkt
- 2.5 Kokepunkt
- 2.6 Tetthet
- 2.7 Fusjonsvarme
- 2.8 Fordampningsvarme
- 2,9 Molar varmekapasitet
- 2.10 Mohs hardhet
- 2.11 Elektronegativitet
- 2.12 Atomeradius
- 2.13 Elektrisk motstand
- 2.14 Isotoper
- 2.15 Kjemi
- 2.16 Syreklynging
- 3 Struktur og elektronisk konfigurasjon
- 3.1 Krystallinske faser
- 3.2 Metallisk binding
- 3.3 oksidasjonstilstander
- 4 Motta
- 5 bruksområder
- 6 Risiko og forholdsregler
- 6.1 Biologiske stoffer
- 6.2 Fysisk
- 7 Referanser
Historie
Etymologi
Historien om wolfram eller wolfram har to ansikter som navnene deres: den ene sveitseren og den andre tyskeren. I 1600-årene, i regioner som for tiden er okkupert av Tyskland og Østerrike, arbeidet gruvearbeidere med utvinning av kobber og tinn for å produsere bronse.
Da fant gruvearbeiderne seg med en torn i prosessen: det var et ekstremt vanskelig mineral å smelte; mineral bestående av wolframitt, (Fe, Mn, Mg) WO4, som beholdt eller "slukte" tinnet som om det var en ulv.
Derav etymologien for dette elementet, "ulv" for ulv på spansk, en ulv som spiste tinn; og 'ram' av skum eller krem, hvis krystaller lignet en lang svart pels. Det var altså at navnet 'wolfram' eller 'wolfram' oppstod til ære for disse første observasjonene.
I 1758, på den sveitsiske siden, et lignende mineral, scheelite, CaWO4, den ble kalt 'tung sten', som betyr 'hard stein'.
Begge navnene, wolfram og wolfram, er mye brukt om hverandre, avhengig av kultur. I Spania, for eksempel og i Vest-Europa, er dette metallet mest kjent som wolfram; mens på det amerikanske kontinentet dominerer navnet wolfram.
Anerkjennelse og oppdagelse
Det var kjent da at mellom det syttende og attende århundre var det to mineraler: wolframitt og scheelitt. Men hvem så at det var et metall som var forskjellig fra de andre i dem? De kunne bare karakteriseres som mineraler, og det var i 1779 at den irske kjemikeren Peter Woulfe nøye analyserte wolfram og utleder eksistensen av wolfram..
På sveitsisk side klarte Carl Wilhelm Scheele i 1781 å isolere wolfram som WO3; og enda mer fikk han wolfram (eller wolfram) syre, HtoWO4 og andre forbindelser.
Dette var imidlertid ikke nok til å komme til det rene metallet, siden det var nødvendig å redusere denne syren; det vil si å underkaste den en prosess slik at den kobles fra oksygen og krystalliseres som metall. Carl Wilhelm Scheele hadde ikke passende ovner eller metodikk for denne kjemiske reduksjonsreaksjonen.
Det var her de spanske brødrene d'Elhuyar, Fausto og Juan José, kom til aksjon, som reduserte begge mineralene (wolframitt og scheelitt) med kull, i byen Bergara. Begge tildeles fortjenesten og æren av å være oppdagerne av metallisk wolfram eller wolfram (W).
Stål og pærer

Som andre metaller, definerer bruken dens historie. Blant de mest fremtredende på slutten av 1800-tallet var stål-wolframlegeringer og wolframfilamenter for å erstatte karbon i elektriske lyspærer. Det kan sies at de første lyspærene, som vi kjenner dem, ble markedsført i 1903-1904.
Eiendommer
Fysisk utseende
Det er et skinnende sølvgrått metall. Skjørt, men veldig vanskelig (ikke forvekslet med seighet). Hvis stykket har høy renhet, blir det formbart og hardt, så mye eller mer som flere stål.
Atomnummer
74.
Molarmasse
183,85 g / mol.
Smeltepunkt
3422ºC.
Kokepunkt
5930ºC.
Tetthet
19,3 g / ml.
Fusjonsvarme
52,31 kJ / mol.
Fordampningsvarme
774 kJ / mol.
Molar varmekapasitet
24,27 kJ / mol.
Mohs hardhet
7.5.
Elektronegativitet
2,36 på Pauling-skalaen.
Atomic radio
139 pm
Elektrisk motstand
52,8 nΩ · m ved 20 ° C.
Isotoper
Det forekommer hovedsakelig i naturen som fem isotoper: 182W, 183W, 184W, 186W og 180W. I henhold til molarmassen på 183 g / mol, som gjennomsnitt av atommassene til disse isotoper (og de andre tretti radioisotoper), har hvert wolfram- eller wolframatom omtrent hundre og ti nøytroner (74 + 110 = 184).
Kjemi
Det er et metall som er svært motstandsdyktig mot korrosjon, som det tynne laget av WO3 Den beskytter den mot angrep av oksygen, syre og baser. Når de er oppløst og utfelt med andre reagenser, oppnås dens salter, som kalles wolframater eller wolframater; i dem har vanligvis wolfram en oksidasjonstilstand på +6 (forutsatt at det er kationer W6+).
Syreklynging
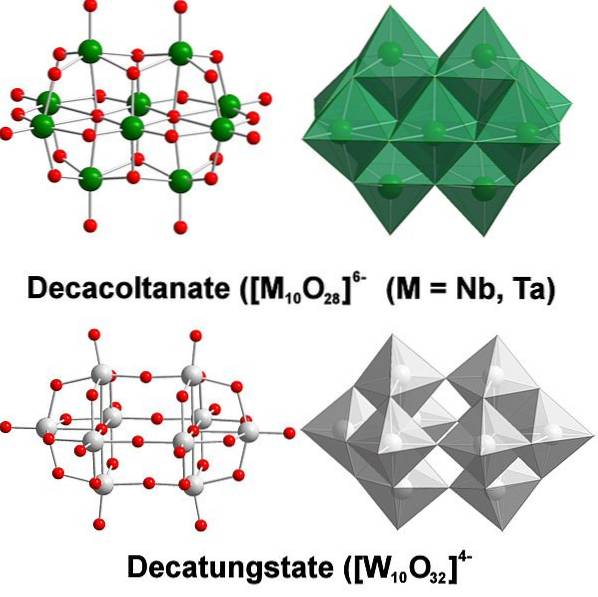
Kjemisk er wolfram ganske spesiell fordi dets ioner har en tendens til å gruppere seg for å danne heteropolysyrer eller polyoksometalater. Hva er de? De er grupper eller klynger av atomer som kommer sammen for å definere en tredimensjonal kropp; Hovedsakelig en med en sfærisk burlignende struktur der de "omslutter" et annet atom.
Det hele starter fra wolframatanionet, WO4to-, som i surt medium protonerer raskt (HWO4-) og binder seg med et nærliggende anion for å danne [WtoELLER7(ÅH)to]to-; og dette blir igjen sammen med en annen [WtoELLER7(ÅH)to]to- å stamme fra [W4ELLER12(ÅH)4]4-. Så videre til det er flere politiske statistikker i løsning.
Paratungstatene A og B, [W7ELLER24]6- og HtoW12ELLER4210-, henholdsvis er de en av de mest fremragende av disse polyanionene.
Det kan være utfordrende å komme med Lewis-omriss og strukturer; men det er i prinsippet nok å visualisere dem som sett med WO-oktaeder6 (toppbilde).
Legg merke til at disse gråaktige oktaedrene ender med å definere dekatungstat, en politungstat; hvis den inneholdt et heteroatom (for eksempel fosfor) inni, ville det da være et polyoksometalat.
Struktur og elektronisk konfigurasjon
Krystallinske faser
Wolframatomer definerer en krystall med en kroppssentrert kubisk struktur (bcc, for kroppssentrert kubikk). Denne krystallinske formen er kjent som α-fasen; mens β-fasen også er kubisk, men litt tettere. Begge faser eller krystallformer, α og β, kan eksistere samtidig i likevekt under normale forhold.
De krystallinske kornene i α-fasen er isometriske, mens de i β-fasen ligner kolonner. Uansett hvordan krystallet er, styres det av metallbindinger som holder W-atomene tett sammen. Ellers kunne ikke de høye smelte- og kokepunktene, eller den høye hardheten og tettheten til wolfram, forklares..
Metallisk binding
Wolframatomer må være tett bundet på en eller annen måte. For å gjøre en antagelse må elektronkonfigurasjonen til dette metallet først følges:
[Xe] 4f145 d46sto
5d-orbitalene er veldig store og uklare, noe som vil antyde at det er effektive baneoverlapp mellom to nærliggende W-atomer. På samme måte bidrar 6s-orbitalene til de resulterende båndene, men i mindre grad. Mens 4f-orbitalene er "dypt i bakgrunnen" og derfor er deres bidrag til metallbindingen mindre.
Dette, størrelsen på atomene og de krystallinske kornene, er variablene som bestemmer hardheten til wolfram og dens tetthet..
Oksidasjonstilstander
I wolfram eller metallisk wolfram har W-atomene oksidasjonstilstand (W0). Når vi går tilbake til den elektroniske konfigurasjonen, kan 5d og 6s orbitaler "tømmes" for elektroner avhengig av om W er i selskap med sterkt elektronegative atomer, som oksygen eller fluor..
Når de to 6s-elektronene går tapt, har wolfram oksidasjonstilstand +2 (Wto+), som får atomet til å trekke seg sammen.
Hvis den også mister alle elektronene i sine 5d-orbitaler, blir oksidasjonstilstanden +6 (W.6+); Herfra kan det ikke bli mer positivt (i teorien), siden 4f-orbitalene, fordi de er interne, ville kreve stor energi for å fjerne elektronene sine. Det vil si at den mest positive oksidasjonstilstanden er +6, hvor wolfram er enda mindre.
Denne wolfram (VI) er veldig stabil under sure forhold eller i mange oksygenerte eller halogenerte forbindelser. Andre mulige og positive oksidasjonstilstander er: +1, +2, +3, +4, +5 og +6.
Wolfram kan også få elektroner hvis det kombineres med atomer som er mindre elektronegative enn det. I dette tilfellet blir atomene større. Det kan maksimalt få fire elektroner; altså ha en oksidasjonstilstand på -4 (W.4-).
Å skaffe
Det ble nevnt tidligere at wolfram finnes i mineralene wolframitt og scheelitt. Avhengig av prosessen oppnås to forbindelser fra dem: wolframoksid, WO3, eller ammoniumparatungstat, (NH4)10(HtoW12ELLER42) · 4HtoO (eller ATP). En av dem kan reduseres til metallisk W med karbon over 1050 ° C.
Det er ikke økonomisk lønnsomt å produsere wolframstenger, da de trenger mye varme (og penger) for å smelte dem. Det er derfor det foretrekkes å produsere det i pulverform for å behandle det på en gang med andre metaller for å oppnå legeringer..
Det er verdt å nevne at Kina er landet med den største wolframproduksjonen over hele verden. Og på det amerikanske kontinentet, Canada, Bolivia og Brasil, okkuperer de også listen over de største produsentene av dette metallet.
applikasjoner

Her er noen av de kjente bruksområdene for dette metallet:
-Saltene ble brukt til å fargelegge bomull av gammel teaterantrekk.
-Kombinert med stål herder det det enda mer, og kan til og med motstå mekaniske kutt i høye hastigheter.
-Sintrede wolframfilamenter har blitt brukt i over hundre år i elektriske pærer og halogenlamper. På grunn av det høye smeltepunktet har det også fungert som et materiale for katodestrålerør, og for dysene til rakettmotorer..
-Erstatter bly i produksjonen av prosjektiler og radioaktive skjold.
-Wolfram nanotråder kan brukes i pH og gassfølsomme nanodeenheter.
-Wolframkatalysatorer ble brukt til å håndtere svovelproduksjon i oljeindustrien.
-Wolframkarbid er den mest brukte av alle forbindelsene. Fra styrking av skjære- og boreverktøy, eller produksjon av deler av militær bevæpning, til bearbeiding av tre, plast og keramikk.
Risiko og forholdsregler
Biologisk
Å være et relativt sjeldent metall i jordskorpen, og dets negative effekter er knappe. I sure jordarter kan det hende at polyungstater ikke påvirker enzymene som bruker molybdatanioner; men i grunnjord, WO4to- griper inn (positivt eller negativt) i de metabolske prosessene til MoO4to- og kobber.
Planter kan for eksempel absorbere oppløselige wolframforbindelser, og når et dyr spiser dem og etter inntak av kjøttet, kommer W-atomer inn i kroppen vår. De fleste blir utvist i urin og avføring, og det er lite kjent hva som skjer med resten av dem..
Dyrestudier har vist at når de inhalerer høye konsentrasjoner av pulverisert wolfram, utvikler de symptomer som ligner på lungekreft.
Ved inntak vil et voksent menneske trenge å drikke tusenvis av liter vann beriket med wolframsalter for å vise en merkbar inhibering av enzymene kolinesterase og fosfatase..
Fysisk
Generelt er wolfram et lavt giftig element, og det er derfor få miljømessige risikoer for helseskader..
Når det gjelder metallisk wolfram, unngå å puste inn støvet; og hvis prøven er solid, bør man huske på at den er veldig tett, og at den kan forårsake fysisk skade hvis den faller eller treffer andre overflater.
Referanser
- Bell Terence. (s.f.). Wolfram (Wolfram): Egenskaper, produksjon, applikasjoner og legeringer. Balansen. Gjenopprettet fra: thebalance.com
- Wikipedia. (2019). Wolfram. Gjenopprettet fra: en.wikipedia.org
- Lenntech B.V. (2019). Wolfram. Gjenopprettet fra: lenntech.com
- Jeff Desjardins. (1. mai 2017). Historien om wolfram, det sterkeste naturlige metallet på jorden. Gjenopprettet fra: visualcapitalist.com
- Doug Stewart. (2019). Wolfram Element Fakta. Gjenopprettet fra: chemicool.com
- Art Fisher og Pam Powell. (s.f.). Wolfram. University of Nevada. Gjenopprettet fra: unce.unr.edu
- Helmenstine, Anne Marie, Ph.D. (2. mars 2019). Wolfram eller Wolfram fakta. Gjenopprettet fra: thoughtco.com



Ingen har kommentert denne artikkelen ennå.