
Bariumoksid (BaO) struktur, egenskaper, bruksområder, risiko

De bariumoksid Det er et uorganisk fast stoff dannet av et bariumatom (Ba) og et oksygenatom (O). Den kjemiske formelen er BaO. Det er et hvitt krystallinsk fast stoff og er hygroskopisk, det vil si at det absorberer fuktighet fra luften, men når det gjør det reagerer det med det..
Den raske reaksjonen av bariumoksid med vann gjør at den brukes i kjemiske analyselaboratorier for å tørke ut, det vil si fjerne vann fra organiske løsningsmidler, som er flytende forbindelser som tjener til å oppløse andre stoffer..

BaO oppfører seg som en sterk base, derfor reagerer den med mange typer syrer. Reagerer for eksempel enkelt med karbondioksid COto fra luften for å danne bariumkarbonat BaCO3.
Den brukes til fremstilling av polymerer for strømkabler og som en ingrediens for harpiks for å tette hull i tenner som er herdet.
Bariumoksid (BaO) brukes også i keramikkindustrien, både for å belegge det med glasur og for å produsere det. Det brukes også i sementblandinger for å øke trykkfastheten til sluttproduktet..
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 Fysiske egenskaper
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Kokepunkt
- 3,5 Tetthet
- 3.6 Løselighet
- 4 Kjemiske egenskaper
- 5 risikoer
- 6 Motta
- 7 bruksområder
- 7.1 Som tørkemiddel for organiske løsningsmidler
- 7.2 I utladningslamper
- 7.3 Ved produksjon av keramikk
- 7.4 Ved tilberedning av sementblandinger
- 7.5 I forskjellige applikasjoner
- 8 Referanser
Struktur
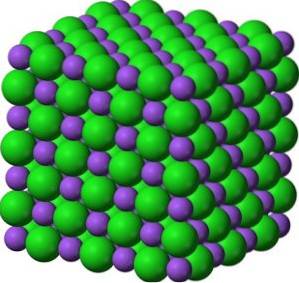
Bariumoksid BaO består av et Ba-kationto+ og et oksygenanion Oto-.
I sine krystaller danner BaO kubiske ioniske nettverk (kubeformet) av natriumkloridtypen.
Elektronkonfigurasjonen til bariumionet er: [Xe] 6s0 ettersom den har mistet de to elektronene til 6s skallet. Denne konfigurasjonen er veldig stabil.
Nomenklatur
-Bariumoksid
-Bariummonoksid
Fysiske egenskaper
Fysisk tilstand
Gulhvitt krystallinsk fast stoff.
Molekylær vekt
153,33 g / mol
Smeltepunkt
1923 ºC
Kokepunkt
Omtrent 2000 ºC.
Tetthet
5,72 g / cm3
Løselighet
Litt løselig i vann: 3,8 g / 100 ml ved 20 ºC.
Kjemiske egenskaper
Bariumoksid BaO reagerer raskt med vann, avgir varme og danner en etsende løsning av bariumhydroksid Ba (OH)to, som er det mest løselige hydroksydet blant jordalkalimetallhydroksidene.
BaO + HtoO → Ba (OH)to
BaO er en sterk base. Reagerer eksotermisk (dvs. med varmeutvikling) med alle typer syrer.
Med COto BaO reagerer for å danne bariumkarbonat BaCO3.
BaO + COto → BaCO3
BaO er hygroskopisk, så hvis det blir utsatt for miljøet, blir det litt etter litt sammen med luftfuktigheten og danner Ba (OH)to som kombineres med karbondioksid COto fra luften for å gi bariumkarbonat BaCO3.
Når bariummonoksid BaO varmes opp i nærvær av luft, kombineres det med oksygen for å danne bariumperoksid BaOto. Reaksjonen er reversibel.
2 BaO + Oto Ba 2 BaOto
I nærvær av vann kan den reagere med aluminium Al eller sink Zn og danne oksidene eller hydroksydene av nevnte metaller og danne hydrogengass Hto.
Kan initiere polymerisering av polymeriserbare organiske forbindelser, så som epoksider.
Risiko
Kan være giftig ved svelging. Det skal ikke komme i kontakt med huden. Det irriterer øynene, huden og luftveiene. Det kan være skadelig for nervesystemet. Det er i stand til å forårsake lave kaliumnivåer, noe som resulterer i hjerte- og muskelsykdommer.
Å skaffe
Bariumoksid BaO kan oppnås ved oppvarming av bariumkarbonat BaCO3 med kull. BaO dannes og karbonmonoksidgass CO frigjøres.
Bacchus3 + C → BaO + 2 CO ↑
applikasjoner
Som tørkemiddel for organiske løsningsmidler
På grunn av den enkle reaksjonen med vann har BaO blitt brukt siden midten av forrige århundre som et tørkemiddel for bensin og basiske eller nøytrale organiske løsningsmidler..
BaO tørker veldig aktivt rundt det, det tar opp fuktighet veldig raskt, med utvikling av ganske mye varme, og danner bariumhydroksyd Ba (OH)to som er stabil opp til ca. 1000 ºC. Av denne grunn kan BaO brukes ved høye temperaturer..
Den har også høy vannabsorpsjonskapasitet. For hvert molekyl av BaO kan ett av vannet og Ba (OH) absorberesto resultatet kan også absorbere en viss mengde vann.
Den er egnet for analytiske kjemilaboratorier. Ikke klissete.
Den kan brukes i eksikkatorer, som er store glassbeholdere med lokk der det indre miljøet holdes tørt. BaO holder tørkemaskinens miniatyratmosfære tørr.

Disse eksikkatorene brukes til å plassere stoffer eller reagenser og forhindre dem i å absorbere vann fra miljøet.
Den brukes også til å tørke basiske gasser som NH-ammoniakk.3.
I utladningslamper
BaO er plassert på elektrodene til utladningslamper som et elektronemitterende materiale.
Utladningslamper er laget av et rør av glass, kvarts eller annet egnet materiale, de inneholder en inert gass og i de fleste tilfeller en metalldamp. Metallisk damp kan være natrium eller kvikksølv.

Elektriske utladninger skjer inne i røret fordi det har en positiv og en negativ elektrode.
BaO er plassert på elektrodene til lampen. Elektronene det sender ut kolliderer med atomene i metallets damp og overfører energi til dem..
Når en elektrisk strøm passerer gjennom denne gassen eller dampen, produseres synlig lys eller ultrafiolett (UV) stråling..
Ved produksjon av keramikk
BaO brukes i komposisjoner av keramisk glasurbelegg.

Imidlertid har det også blitt testet som et tilsetningsstoff ved fremstilling av glasskeramikk.
BaO forbedrer effektivt de mekaniske egenskapene og den kjemiske motstanden til denne typen keramikk. Det har en sterk innflytelse på de termiske egenskapene og sammensetningen av den krystallinske fasen av de oppnådde materialene..
Ved fremstilling av sementblandinger
BaO er testet som en komponent av fosfoaluminat sement.
Denne typen sement er nyttig i marine miljøer, siden den ikke har samme tendens til å hydrere som andre typer sement, slik at den ikke lider av poredannelse eller ekspansjon..
Imidlertid må fosfoaluminatsement styrkes i sin mekaniske ytelse for å motstå marine strømmer og slag fra flytende isbiter som er tilstede i havet..
Tilsetningen av BaO til fosfoaluminatsementet modifiserer mineralstrukturen til nevnte materiale, forbedrer porestrukturen og øker sementpastaens trykkfasthet betydelig..
Med andre ord forbedrer BaO trykkfastheten til denne typen sement..

I forskjellige applikasjoner
Det brukes som en ingrediens for å gi opasitet i tannharpikser for å fylle hull i tennene, utført av tannleger.
Det brukes også som et kjernedannende middel for fremstilling av polyvinylidenfluoridpolymerer som brukes til å isolere strømkabler..
Referanser
- Partyka, J. et al. (2016). Effekt av tilsetning av BaO på sintring av glasskeramiske materialer fra SiOto-TiltoELLER3-NatoGREITtoO-CaO / MgO-system. J Therm Anal Calorim (2016) 125: 1095. Gjenopprettet fra link.springer.com.
- Zhang, P. et al. (2019). Effekt av BaO på mineralstruktur og hydratiseringsadferd av fosfoaluminat sement. J Therm Anal Calorim (2019) 136: 2319. Gjenopprettet fra link.springer.com.
- OSS. National Library of Medicine. (2019). Bariumoksid. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Smith, N.A. (2003). Belysning. Prinsipp. I Electrical Engineer's Reference Book (Sixteenth Edition). Gjenopprettet fra sciencedirect.com.
- Ebnesajjad, S. (2003). Fluorpolymerskum. Skummende PVDF. I smelte bearbeidbare fluorplaster. Gjenopprettet fra sciencedirect.com.
- Booth, H.S. og McIntyre, L.H. (1930). Bariumoksid som et dessertmiddel. Ind. Eng. Chem. Anal. Utg. 1930, 2, 1, 12-15. Gjenopprettet fra pubs.acs.org.


Ingen har kommentert denne artikkelen ennå.