
Natriumacetatstruktur, egenskaper, syntese, bruksområder

De natriumacetat er et natriumsalt av eddiksyre hvis molekylformel er CtoH3ELLERtoNa. Den består av et eksentrisk hvitt pulver, hovedsakelig til stede i to former: vannfri og trihydratisert. Begge er veldig løselige i vann, det universelle løsningsmidlet; men ikke så løselig i alkoholer eller aceton.
Den vannfrie formen har en tetthet, et smeltepunkt og et kokepunkt med høyere verdier enn de som presenteres av trihydratformen av natriumacetat. Dette er fordi vannmolekylene forstyrrer interaksjonene mellom Na-ionene.+ og CH3COO-.

Natriumacetat er stabilt, spesielt når det lagres mellom 2 og 8 ° C; men det er utsatt for virkningen av sterke oksidasjonsmidler og halogener.
Den kan fremstilles ved omsetning av natriumbikarbonat med eddiksyre. Også med reaksjonen av eddiksyre med natriumhydroksid. Begge reaksjonene er enkle å produsere og rimelige; den første kan til og med gjøres hjemme.
Dette saltet er en lav giftig forbindelse. Produserer hudirritasjon, bare etter hyppig og kontinuerlig kontakt. Det er mildt irriterende for øynene, men kan irritere luftveiene. Det er ingen informasjon om skadelig effekt av inntaket..
Den har mange bruksområder og applikasjoner, og fremhever pH-buffringsfunksjonen sammen med eddiksyre. Acetatbufferen har en pKa = 4,7; som gir høy effektivitet i pH-regulering i et surt miljø med pH-verdier mellom 3 og 6.
På grunn av sin lave toksisitet og dets egenskaper, har den blitt mye brukt for å forbedre smaken av mat, samt et middel som gir beskyttelse mot ødeleggelse på grunn av dets virkning mot mikrober..
Artikkelindeks
- 1 Struktur av natriumacetat
- 1.1 Hydrerte krystaller
- 2 eiendommer
- 2.1 Navn
- 2.2 Molarmasse
- 2.3 Utseende
- 2.4 Lukt
- 2,5 Tetthet
- 2.6 Smeltepunkt
- 2.7 Kokepunkt
- 2.8 Løselighet
- 2.9 Surhet
- 2.10 Grunnleggende
- 2.11 Brytningsindeks (ηD)
- 2.12 Kalorikapasitet
- 2.13 Flammepunkt
- 2.14 Selvantennelsestemperatur
- 2,15 pH
- 2.16 Stabilitet
- 2.17 Reaksjoner
- 3 Syntese
- 4 bruksområder
- 4.1 Termiske poser
- 4.2 Industriell
- 4.3 Medisinsk bruk
- 4,4 pH-bufferløsning
- 4.5 Forskningslaboratorier
- 4.6 Konservering av mat
- 4.7 Konservering av betong
- 5 Eksperimenter for unge mennesker
- 5.1 Eksperiment 1
- 5.2 Eksperiment 2
- 6 Toksisitet
- 7 Referanser
Struktur av natriumacetat
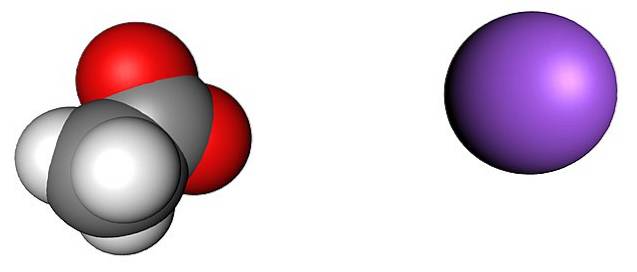
Bildet over viser ionene som utgjør vannfrie natriumacetatkrystaller (uten vann). Den lilla sfæren tilsvarer Na-kationen+, og det molekylære ionet til venstre er acetat, CH3COO-, med oksygenatomer representert av røde kuler.
Disse parene, i henhold til formelen CH3COONa, er i forholdet 1: 1; for hvert CH-anion3COO-, det må være et Na-kation+ tiltrukket av sin negative ladning og omvendt. Dermed ender attraksjonene mellom dem og frastøtingen mellom like ladninger med å etablere strukturelle mønstre som definerer en krystall, hvis minimumsuttrykk er enhetscellen.
Nevnte enhetscelle, som krystallen som helhet, varierer avhengig av arrangementet av ionene i rommet; det er ikke alltid det samme, selv for det samme krystallinske systemet. For eksempel kan vannfritt natriumacetat danne to ortorombiske polymorfe, hvorav den ene er avbildet nedenfor:
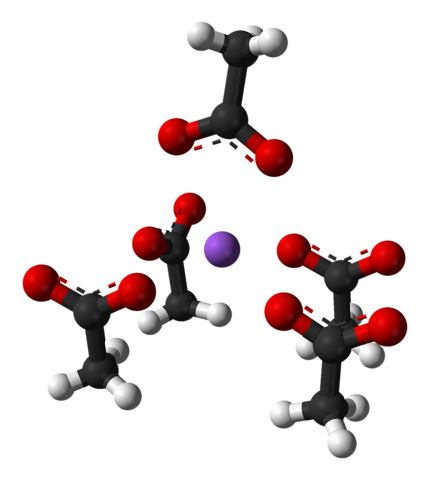
Legg merke til arrangementet av ionene: fire CH-ioner3COO- de låser opp en Na+ på en slik måte at de "tegner" en forvrengt firkantbasert pyramide. Hver av disse kap3COO- i sin tur samhandler de med en annen Na+ ved siden av.
Hydrerte krystaller
Sodiumacetat har høy affinitet for vann; faktisk er den lekker, det vil si at den beholder fuktighet til den oppløses i den. Jo høyere luftfuktighet, jo raskere "smelter" den. Dette er fordi både CH3COO- som Na+ kan hydrere, omgir seg med vannmolekyler som orienterer dipolene mot ladningene (Na+ Åhto, CH3COO- HOH).
Når dette saltet tilberedes i laboratoriet eller hjemme, er dets affinitet for vann slik at det allerede ved normale temperaturer allerede oppnås som et hydrat; CH3COONa 3HtoO. Krystallene slutter å være ortorombiske og blir monokliniske, siden de nå inneholder tre vannmolekyler for hvert CH-par3COO- og Na+.
Eiendommer
Navn
-Natriumacetat.
-Natriumetanoat (IUPAC).
Molarmasse
-Vannfri: 82,03 g / mol.
-Trihydrat: 136,03 g / mol.
Utseende
Nydelig hvitt pulver.
Lukt
Til eddik ved oppvarming til nedbrytning.
Tetthet
-Vannfri: 1,528 g / cm3 ved 20 ºC.
-Trihydrat: 1,45 g / cm3 ved 20 ºC.
Smeltepunkt
-Vannfri: 324 ºC (615 ºF, 597 K).
-Trihydrat: 58 ºC (136 ºF, 331 K).
Kokepunkt
-Vannfri: 881,4 ºC (1.618,5 ºF, 1.154,5 K).
-Trihydrat: 122 ° C (252 ° F, 395 K). Det nedbrytes.
Løselighet
I vann
-Vannfri: 123,3 g / 100 ml ved 20 ° C.
-Trihydrat: 46,4 g / 100 ml ved 20 ° C.
I metanol
16 g / 100 g ved 15 ºC.
I etanol
5,3 g / 100 ml (trihydrat).
I aceton
0,5 g / kg ved 15 ° C.
Surhet
pKa: 24 (20 ºC).
Grunnleggende
pKb: 9,25. Her er det bevist at natriumacetat er et basisk salt fordi det har pKb mindre enn dets pKa.
Brytningsindeks (ηD)
1.464
Kalorikapasitet
-100,83 J / mol K (vannfri).
-229,9 J / mol K (trihydrat).
antennelsespunkt
Over 250 ° C.
Selvantennelsestemperatur
600 ºC.
pH
8,9 (0,1 M løsning ved 25 ° C).
Stabilitet
Stabil. Uforenlig med sterke oksidasjonsmidler og halogener. Følsom for fuktighet.
Reaksjoner
Natriumacetat kan danne en ester ved å reagere med et alkylhalogenid; for eksempel bromoetan:
CH3COONa + BrCHtoCH3 => CH3COOCHtoCH3 + NaBr
Natriumacetat-dekarboksylater til metan (pyrolyse) i nærvær av NaOH:
CH3COONa + NaOH => CH4 + NatoCO3
Reaksjonen katalyseres av cesiumsalter.
Syntese
Natriumacetat kan produseres billig i laboratoriet ved å reagere natriumbikarbonat med eddiksyre:
NaHCO3 + CH3COOH => CH3COONa + HtoCO3
Denne reaksjonen er ledsaget av tilstedeværelsen i en intens bobling på grunn av nedbrytningen av karbonsyre i vann og karbondioksid..
HtoCO3 => HtoO + COto
Industrielt produseres natriumacetat ved å reagere eddiksyre med natriumhydroksid.
CH3COOH + NaOH => CH3COONa + HtoELLER
applikasjoner
Termiske poser
Natriumacetat brukes til å produsere termiske poser.
I utgangspunktet oppløses saltkrystallene i et volum vann for å fremstille en løsning som blir overmettet..
Deretter oppvarmes løsningen til en temperatur høyere enn 58 ºC, som er dens smeltepunkt. Den overmettede løsningen får avkjøles til romtemperatur og krystalldannelse blir ikke observert; løsningen er superkjølt.
Fraværet av krystaller forklares med det faktum at væskemolekylene er for uordnede og ikke har den riktige orienteringen for å nå krystalliseringstemperaturen. Væsken er i en metastabil tilstand, en tilstand av ubalanse.
Gitt ustabiliteten til den superkjølte væsken, er enhver forstyrrelse tilstrekkelig til å igangsette krystallisering. Når det gjelder termiske poser, presses et mekanisk feste for å røre væsken og initiere dannelsen av krystaller og størkningen av natriumacetattrihydratløsningen..
Når krystallisering oppstår, øker temperaturen. Sodiumacetat trihydratkrystaller får utseendet på is, men de er varme, og det er derfor det kalles "varm is.".
Industriell
-Natriumacetat brukes i tekstilindustrien som et mordant i stofffarging
-Nøytraliserer svovelsyreavfall
-Den brukes i behandlingen av bomull for produksjon av bomullsputer, som kan brukes til personlig rengjøring og til medisinske formål
-Den brukes til beising av metaller før forkromning
-Samarbeider slik at kloroprenvulkanisering ikke forekommer i produksjonen av syntetisk gummi
-Går inn i rensing av glukose
-Det brukes i garvning av skinn.
Medisinsk bruk
Natriumacetat er en av forbindelsene som brukes til å gi elektrolytter gitt til pasienter intravenøst..
Det brukes til å korrigere natriumnivåer hos hyponatremiske pasienter, også ved korreksjon av metabolsk acidose og alkalisering av urinen..
PH bufferløsning
Den brukes som en pH-regulator i mange enzymatiske reaksjoner som oppstår mellom pH 3 og pH 6.
Den forskjellige pH i acetatbufferoppløsningen oppnås ved variasjonen av konsentrasjonen av eddiksyre og natriumacetat..
For eksempel, for å oppnå en pH 4,5, har bufferløsningen en eddiksyrekonsentrasjon på 3,8 g / L og en vannfri natriumacetatkonsentrasjon på 3,0 g / L..
Konsentrasjonen av acetatbufferen kan økes, og i samme andel økes komponentene i løsningen som er nødvendige for å oppnå ønsket pH.
Acetat / acetonitrilbuffer brukes i kapillærelektroforese ved separasjon av fotoberberiner.
Forskningslaboratorier
-Natriumacetat er et svakt nukleofilt middel som brukes i den anioniske polymeriseringen av β-lakton.
-Det brukes som et reagens i kjernemagnetisk resonans av biologiske makromolekyler.
-Det brukes i ekstraksjon av DNA fra celler. Sodium er et kation som samhandler med de negative ladningene av fosfater som er tilstede i DNA, noe som hjelper til med kondensering. I nærvær av etanol danner DNA et bunnfall som deretter kan skilles i det vandige laget.
Bevaring av mat
-Hjelper med å forhindre bakterievekst, i tillegg til å forhindre generering av overflødig surhet som forårsaker matsvinn, og opprettholder dermed en spesifikk pH.
-Natrium i acetat forbedrer smaken av mat.
-Natriumacetat brukes til fremstilling av syltede grønnsaker: agurk, gulrot, løk, etc. I tillegg brukes den til konservering av kjøtt.
Bevaring av betong
Betong blir skadet av vannets virkning, noe som forkorter varigheten. Natriumacetat fungerer som et betongforseglingsmiddel som gjør det vanntett, og forlenger dets opprinnelige egenskaper.
Ungdomseksperimenter
Eksperiment 1
Et enkelt eksperiment er syntesen av natriumacetat ved å omsette natriumbikarbonat med eddik (5% eddiksyre).
30 ml eddik plasseres i et begerglass og ca. 3,5 g bikarbonat tilsettes..
Natriumacetat og karbonsyre dannes i reaksjonen. Syre brytes ned i karbondioksid og vann. Produksjonen av karbondioksid vil gi en intens bobling i løsningen.
For å samle opp natriumacetatet, fordamper vannet og oppvarmer løsningen.
Eksperiment 2
Et annet enkelt eksperiment er dannelsen av krystaller av natriumacetattrihydrat.
For å gjøre dette, veies ca. 20 g natriumacetattrihydrat og plasseres i et beger, og deretter tilsettes 10 ml vann. Løsningen oppvarmes til en temperatur over 58 ºC.
Natriumacetat er fullstendig oppløst for å sikre at løsningen er overmettet. Tidligere er en Pietri-rett plassert på en kald overflate.
Innholdet i begeret med acetattrihydratet helles sakte i Pietri-skålen. Væsketemperaturen i kapselen begynner å synke, selv under smeltepunktet, uten å observere krystalliseringen eller størkningen av natriumacetattrihydratet..
Vanligvis tilsettes en liten mengde salt for å frembringe krystallisering av natriumacetattrihydratet for å tjene som krystalliseringskjerne. Andre ganger oppstår en liten forstyrrelse av løsningen for å starte krystalliseringen av natriumacetat.
Sodiumacetat trihydratkrystaller ser ut som is, men hvis du berører dem, vil du legge merke til at de er relativt varme. Av denne grunn kalles salt "varm is".
Toksisitet
Natriumacetat er en veldig lav giftig forbindelse. Det er heller ikke klassifisert som hud- og luftveissensibilisator..
I tillegg er natriumacetat ikke klassifisert som et kimcelle mutagent, kreftfremkallende eller reproduksjonstoksisk middel..
Kort fortalt er det litt irriterende for øynene. Luftveiene kan irritere seg etter innånding. Hyppig og konstant kontakt med huden kan forårsake irritasjon.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- WorldOfChemicals. (16. januar 2017). Hvordan forberede jeg natriumacetat hjemme? Gjenopprettet fra: medium.com
- Nasjonalt senter for bioteknologisk informasjon. (2019). Natriumacetat. PubChem-database. CID = 517045. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- S. Cameron, K. M. Mannan og M. O. Rahman. (1976). Krystallstrukturen til natriumacetat-trihydrat. Acta Cryst. B32, 87.
- Wikipedia. (2019). Natriumacetat. Gjenopprettet fra: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (24. januar 2019). Lag varm is av eddik og natron. Gjenopprettet fra: thoughtco.com
- Kjemisk bok. (2017). Natriumacetat. Gjenopprettet fra: chemicalbook.com
- Wasserman Robin. (2019). Bruk av natriumacetat. Gjenopprettet fra: livestrong.com
- Drugbank. (2019). Natriumacetat. Gjenopprettet fra: drugbank.ca
Ingen har kommentert denne artikkelen ennå.