
Borhistorie, egenskaper, struktur, bruksområder
De bor Det er et ikke-metallisk element som leder gruppe 13 i det periodiske systemet og er representert med det kjemiske symbolet B. Ditt atomnummer er 5, og det er det eneste ikke-metalliske elementet i gruppen; selv om noen kjemikere anser det som en metalloid.
Det fremstår som et svartbrunt pulver, og finnes i en andel på 10 ppm i forhold til jordskorpen. Derfor er det ikke et av de mest utbredte elementene.

Det finnes som en del av flere mineraler som boraks eller natriumborat, dette er det vanligste bormineralet. Det er også kurnitt, en annen form for natriumborat; colemanitt eller kalsiumborat; og uleksitt, natrium og kalsiumborat.
Borater utvinnes i USA, Tibet, Kina og Chile med en verdensproduksjon på omtrent to millioner tonn per år.
Dette elementet har tretten isotoper, hvor det mest forekommer elleveB, som utgjør 80,1 vekt-% bor, og 10B, som danner de resterende 19,9%.
Bor er et viktig sporstoff for planter, som griper inn i syntesen av noen viktige planteproteiner og bidrar til absorpsjon av vann. Hos pattedyr ser det ut til å være nødvendig for beinhelsen.
Selv om bor ble oppdaget i 1808 av den engelske kjemikeren Sir Humphry Davy, og de franske kjemikerne Jacques Thérnard og Joseph Gay-Lussac, ble boraks siden begynnelsen av vår tid i Kina brukt til fremstilling av emaljekaramikk..
Bor og dets forbindelser har mange bruksområder og anvendelser, alt fra bruk til konservering av mat, spesielt margarin og fisk, til bruk ved behandling av kreftsvulster i hjernen, blæren, prostata og andre organer.
Bor er lite løselig i vann, men forbindelsene er det. Dette kan være en mekanisme for konsentrasjon av bor, samt en kilde til forgiftning med elementet..
Artikkelindeks
- 1 Historie
- 1.1 Bakgrunn
- 1.2 Elementfunn
- 1.3 Identifikasjon og isolasjon
- 2 eiendommer
- 2.1 Fysisk beskrivelse
- 2.2 Molarmasse
- 2.3 Smeltepunkt
- 2.4 Kokepunkt
- 2,5 Tetthet
- 2.6 Fusjonsvarme
- 2.7 Fordampningsvarme
- 2.8 Molar varmekapasitet
- 2.9 Ioniseringsenergi
- 2.10 Elektronegativitet
- 2.11 Atomeradius
- 2,12 atomvolum
- 2.13 Varmeledningsevne
- 2.14 Elektrisk motstand
- 2.15 Hardhet
- 2.16 Reaktivitet
- 3 Struktur og elektronkonfigurasjon av bor
- 3.1 Koblinger og strukturelle enheter i bor
- 3.2 α-rombohedral bor
- 3.3 β-rombohedral bor
- 3.4 Bor-γ bergsalt
- 3.5 Kubikk og amorf
- 3.6 Borofener
- 3.7 Elektronisk konfigurasjon
- 4 Motta
- 5 bruksområder
- 5.1 I industrien
- 5.2 I medisin
- 5.3 Biologisk virkning
- 6 Risiko og forholdsregler
- 7 Referanser
Historie
Bakgrunn
Siden eldgamle tider har mennesket brukt borforbindelser i forskjellige aktiviteter. Borax, et mineral kjent som tincal, ble brukt i Kina i 300 e.Kr. i produksjonen av emaljekaramikk.
Den persiske alkymisten Rhazes (865-925) nevnte første gang borforbindelser. Rhazes klassifiserte mineralene i seks klasser, hvorav den ene var boracios som inkluderte bor.
Agricola, rundt 1600, rapporterte bruken av boraks som en strøm i metallurgi. I 1777 ble tilstedeværelsen av borsyre anerkjent i en varm vårstrøm nær Firenze.
Elementfunn
Humphry Davy, ved elektrolyse av en boraksoppløsning, observerte akkumuleringen av et svart bunnfall på en av elektrodene. Han oppvarmet også boroksid (BtoELLER3) med kalium, og produserte et svartbrunt pulver som var den kjente formen for bor.
Gay-Lussac og Thénard reduserte borsyre ved høye temperaturer i nærvær av jern for å produsere bor. De viste også omvendt prosess, det vil si hvor borsyre er et produkt av oksidasjon av bor.
Identifisering og isolasjon
Jöns Jakob Berzelius (1827) lyktes i å identifisere bor som et nytt element. I 1892 klarte den franske kjemikeren Henri Moissan å produsere bor med 98% renhet. Selv om det påpekes at bor ble produsert i ren form av den amerikanske kjemikeren Ezekiel Weintraub, i år 1909.
Eiendommer
Fysisk beskrivelse
Krystallinsk fast eller amorft svartbrunt pulver.
Molarmasse
10,821 g / mol.
Smeltepunkt
2076 ºC.
Kokepunkt
3927 ºC.
Tetthet
-Væske: 2,08 g / cm3.
-Krystallinsk og amorf ved 20 ºC: 2,34 g / cm3.
Fusjonsvarme
50,2 kJ / mol.
Fordampningsvarme
508 kJ / mol.
Molar varmekapasitet
11,087 J / (mol K)
Ioniseringsenergi
-Første nivå: 800,6 kJ / mol.
-Andre nivå: 2427 kJ / mol.
-Tredje nivå: 3.659,7 kJ / mol.
Elektronegativitet
2.04 på Pauling-skalaen.
Atomic radio
90 pm (empirisk).
Atomisk volum
4,16 cm3/ mol.
Termisk ledningsevne
27,4 W / m.K
Elektrisk motstand
~ 106 Ω.m (ved 20 ºC).
Bor ved høye temperaturer er en god elektrisk leder, men ved romtemperatur blir det nesten en isolator.
Hardhet
~ 9,5 på Mohs-skalaen.
Reaktivitet
Bor påvirkes ikke av saltsyre ved kokepunktet. Imidlertid omdannes den av varm salpetersyre til borsyre (H3BO3). Bor oppfører seg kjemisk som et ikke-metall.
Reagerer med alle halogener for å gi svært reaktive trihalogenider. Disse har den generelle formelen BX3, hvor X representerer halogen.
Den kombineres med forskjellige elementer for å stamme borider. Noen av dem er blant de vanskeligste stoffene; for eksempel bornitrid (BN). Bor kombineres med oksygen for å danne bortrioksid.
Struktur og elektronkonfigurasjon av bor
Koblinger og strukturelle enheter i bor
Før du adresserer strukturene av bor (krystallinsk eller amorf), er det viktig å huske på hvordan atomene kan knyttes sammen. B-B-bindingen er i det vesentlige kovalent; Ikke bare det, men fordi boratomer naturlig har elektronisk mangel, vil de prøve å levere det i sine obligasjoner på en eller annen måte..
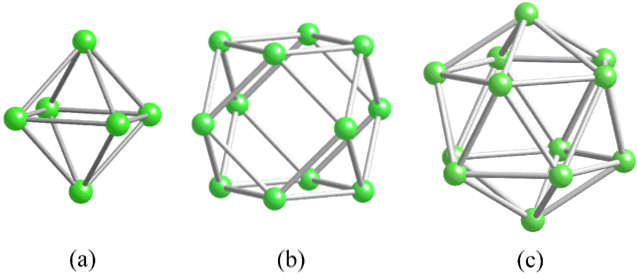
I bor observeres en spesiell type kovalent binding: den med tre sentre og to elektroner, 3c2e. Her deler tre boratomer to elektroner, og definerer en trekant, en av de mange ansiktene som finnes i deres strukturelle polyhedra (øvre bilde).
Fra venstre til høyre har vi: oktaeder (a, B.6), kuboktaeder (b, B12), og isokashedronen (c, B12 også). Alle disse enhetene har en egenskap: de er elektronfattige. Derfor har de en tendens til å knytte kovalent til hverandre; og resultatet er en fest med fantastiske lenker.
I hver trekant av disse polyedrene er 3c2e-bindingen til stede. Ellers kunne det ikke forklares hvordan bor, som er i stand til å danne bare tre kovalente bindinger i henhold til Valencia Bond Theory, kan ha opptil fem bindinger i disse polyhedrale enhetene..
Borstrukturer består da av en ordning og repetisjon av disse enhetene som ender opp med å definere en krystall (eller et amorft fast stoff).
Α-rombohedral bor
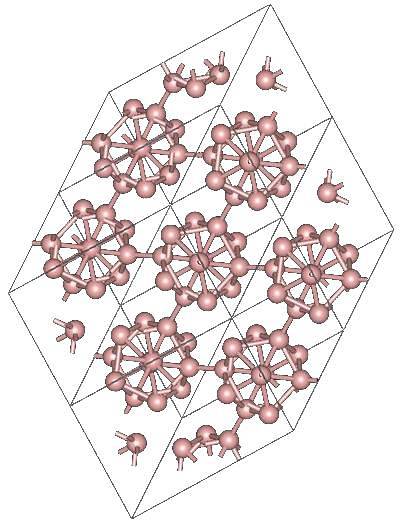
Det kan være andre polyhedrale borenheter, så vel som en sammensatt av bare to atomer, Bto; en bor "linje" som må være bundet til andre atomer på grunn av sin høye elektroniske mangel.
Icosaeder er uten tvil den foretrukne borenheten; den som passer deg best. På bildet over kan du for eksempel se hvordan disse B-enhetene12 fletter sammen for å definere rombohedral krystall av Bor-α.
Hvis du ønsket å isolere en av disse icosahedraene, ville det være en komplisert oppgave, siden dens elektroniske mangel tvinger dem til å definere en krystall der hver og en bidrar med elektronene som de andre naboene trenger..
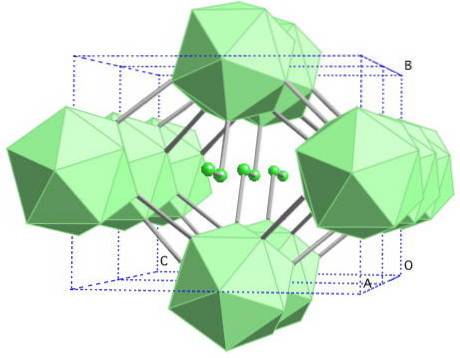
Β-rombohedral bor
Allotropen bor β-rhombohedral, som navnet allerede indikerer, har rhombohedral krystaller som bor-α; men det er forskjellig i strukturelle enheter. Det ser ut som et fremmed skip laget av boratomer.
Hvis du ser nøye, kan de ikosahedriske enhetene sees på en diskret og smeltet måte (i midten). Det er også B-enheter10 og ensomme boratomer som fungerer som en bro for de nevnte enhetene. Av alt er dette den mest stabile borallotropen.
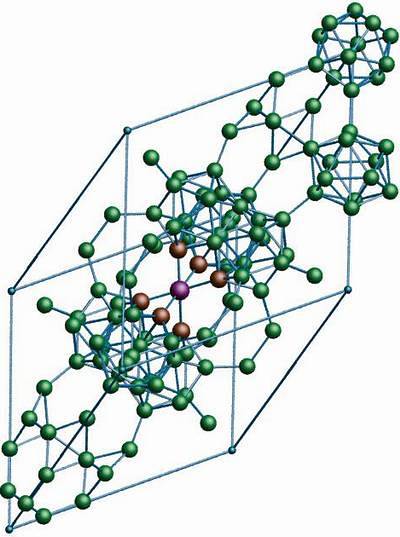
Bor-γ bergsalt
I denne borallotropen koordineres B-enheteneto og B12. Bto er så elektronisk mangelfull at den faktisk fjerner elektroner fra B12 og det er derfor en ionisk karakter i dette faste stoffet. Det vil si at de ikke bare er kovalent bundet, men det er elektrostatisk tiltrekning av typen [Bto-] [B12+].
Bor-y krystalliserer seg til en steinsaltstruktur, den samme som for NaCl. Det oppnås ved å utsette andre borallotroper for høyt trykk (20 GPa) og temperaturer (1800 ° C), for senere å forbli stabile under normale forhold. Dens stabilitet konkurrerer faktisk med stabiliteten til β-rombohedral bor.
Kubikk og amorf
Andre borallotroper består av aggregater av B-atomer som om de var forbundet med en metallbinding, eller som om de var ioniske krystaller; det vil si at det er en kubikk bor.
Også, og ikke mindre viktig, er amorf bor, hvis arrangement av B-enheter12 det er tilfeldig og rotete. Vises som et glassaktig fast eller fint pulver i kjedelige brune og mørke farger.
Borophenes
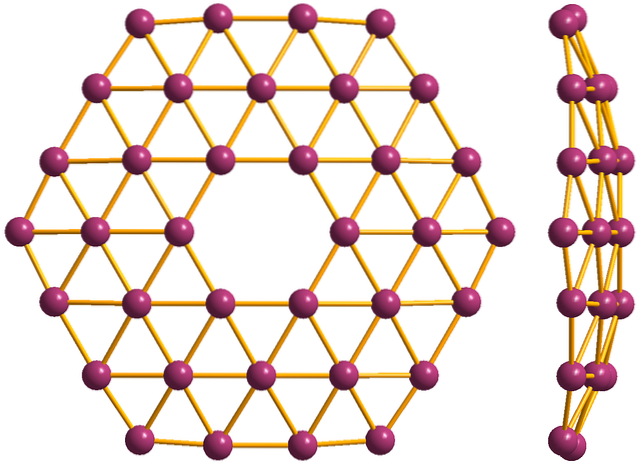
Og til slutt er det den nyeste og mest bisarre allotropen av bor: borofener (toppbilde). Den består av et monolag av boratomer; ekstremt tynn og analog med grafen. Vær oppmerksom på at den bevarer de berømte trekanter, som er karakteristisk for den elektroniske mangelen som atomer lider av.
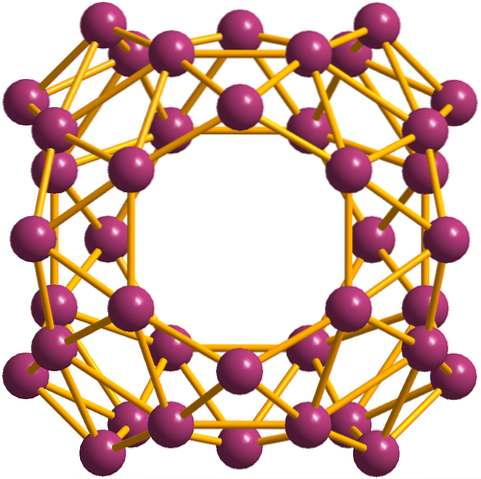
I tillegg til borofenene, hvorav B36 er det enkleste og minste, det er også borklyngene. Borosfæren (bildet nedenfor) består av et kuleformet sfærisk bur med førti boratomer, B40; men i stedet for å ha glatte kanter, er de brå og taggete:
Elektronisk konfigurasjon
Elektronkonfigurasjonen til bor er:
[Han] 2sto 2 s1
Den har derfor tre valenselektroner. Det tar fem til for å fullføre valensoktet, og det kan knapt danne tre kovalente bindinger; den trenger en fjerde dativlink for å fullføre oktetten. Bor kan miste sine tre elektroner for å få en oksidasjonstilstand på +3.
Å skaffe
Bor isoleres ved å redusere borsyre med magnesium eller aluminium; metode som den som brukes av Gay-Lussac og Thénard. Det har vanskeligheter med å forurense bor med boridene av disse metallene.
En prøve med høy renhet kan oppnås ved reduksjon av gassfase av bortriklorid, eller tribromid, med hydrogen på elektrisk oppvarmede filament av tantal..
Et bor med høy renhet fremstilles ved høy temperatur nedbrytning av diboran, etterfulgt av rensing ved sonefusjon eller Czocharalski-prosesser..
applikasjoner
I bransjen
Elementbor er blitt brukt til herding av stål. I en legering med jern som inneholder 0,001 til 0,005% bor. Det brukes også i ikke-jernholdig industri, vanligvis som en deoxidizer.
I tillegg brukes bor som avgasser i kobber og kobberbaserte legeringer med høy ledning. I halvlederindustrien tilsettes små mengder bor nøye som et dopingsmiddel for silisium og germanium..
Boroksid (BtoELLER3) blandes med silisiumdioksyd for å lage et varmebestandig glass (borosilikatglass), brukt i kjøkkenutstyr og visse laboratorieutstyr.
Borkarbid (B4C) er et ekstremt hardt stoff som brukes som et slipende og forsterkende middel i komposittmaterialer. Aluminiumborid (AlB12) brukes som erstatning for diamantstøv for sliping og polering.
Bor brukes i legeringer, for eksempel magneter av sjeldne jordarter, ved legering av jern og neodym. De dannede magneter brukes til produksjon av mikrofoner, magnetiske brytere, hodetelefoner og partikkelakseleratorer.
I medisin
Kapasiteten til bor-10 isotopen (10B) for å fange nøytroner, har emitterende α-type stråling blitt brukt til behandling av hjernesvulster i en teknikk kjent som Boron Neutron Capture Therapy (BNCT).
De 10Forbindelse B akkumuleres i kreftsvulsten. Deretter bestråles tumorområdet med nøytroner. Disse samhandler med 10B, som forårsaker utslipp av α-partikler. Disse partiklene har en høy relativ biologisk effekt, og på grunn av deres store størrelse har de lite rekkevidde..
Derfor forblir den destruktive virkningen av α-partiklene begrenset i tumorcellene og utfører ødeleggelsen av dem. BNCT brukes også til behandling av kreftsvulster i nakke, lever, blære og prostata..
Biologisk handling
En liten mengde bor, i form av borsyre eller borat, er nødvendig for vekst av mange planter. En bormangel manifesterer seg i misdannet plantevekst; det "brune hjertet" av grønnsaker; og den "tørre råten" av sukkerroer.
Bor kan være nødvendig i små mengder for å opprettholde beinhelsen. Det er studier som indikerer at mangel på bor ville være involvert i genereringen av leddgikt. Det vil også gripe inn i hjernefunksjoner som minne og hånd-øye-koordinasjon.
Noen eksperter påpeker at 1,5 til 3 mg bor bør inkluderes i det daglige kostholdet.
Risiko og forsiktighet
Bor, boroksid, borsyre og borater regnes som ikke-giftige. LD50 for dyr er 6 g bor / kg kroppsvekt, mens stoffer med LD50 større enn 2 g / kg kroppsvekt anses som ikke-giftige..
På den annen side forårsaker forbruk av mer enn 0,5 mg bor per dag i 50 dager mindre fordøyelsesproblemer, noe som tyder på toksisitet. Noen rapporter indikerer at et overskudd i inntaket av bor kan påvirke funksjonen til mage, lever, nyrer og hjerne.
Også kortvarige irriterende effekter på nasopharynx, øvre luftveier og øyne er rapportert fra boreksponering..
Rapporter om bortoksisitet er knappe, og i mange tilfeller forekommer toksisitet ved svært høye doser, høyere enn de som befolkningen generelt er utsatt for..
Anbefalingen er å overvåke borinnholdet i matvarer, spesielt grønnsaker og frukt. Statlige helsebyråer må sørge for at borkonsentrasjonen av vannet ikke overskrider de tillatte grensene..
Arbeidere som er utsatt for borholdig støv, bør bruke beskyttelsesmasker, hansker og spesielle støvler..
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Allotropes av bor. Gjenopprettet fra: en.wikipedia.org
- Prof. Robert J. Lancashire. (2014). Foredrag 5b. Strukturen til elementene (ikke-metaller, B, C). Institutt for kjemi, University of the West Indies, Mona Campus, Kingston 7, Jamaica. Gjenopprettet fra: chem.uwimona.edu.jm
- Manisha Lalloo. (28. januar 2009). Ultrarent borstruktur oppdaget. Chemistry World. Gjenopprettet fra: chemistryworld.com
- Bell Terence. (16. desember 2018). En profil av metallboret. Gjenopprettet fra: thebalance.com
- Redaksjonen av Encyclopaedia Britannica. (2019). Bor. Gjenopprettet fra: britannica.com
- Byrået for giftige stoffer og sykdomsregister. (2010). ToxFAQs ™ på bor. [PDF]. Gjenopprettet fra: atsdr.cdc.gov
- Helmenstine, Anne Marie, Ph.D. (6. februar 2019). Bor kjemiske og fysiske egenskaper. Gjenopprettet fra: thoughtco.com


Ingen har kommentert denne artikkelen ennå.