
Butenegenskaper, kjemisk struktur og bruksområder
De butene er navnet gitt til en serie på fire isomerer med den kjemiske formelen C4H8. De er alkener eller olefiner, det vil si at de har en C = C dobbeltbinding i strukturen. I tillegg er de hydrokarboner, som kan finnes i oljefelt eller stammer fra termisk krakking og får produkter med lavere molekylvekt..
De fire isomerer reagerer med oksygen, frigjør varme og gul flamme. På samme måte kan de reagere med et bredt spekter av små molekyler som legger til deres dobbeltbinding..
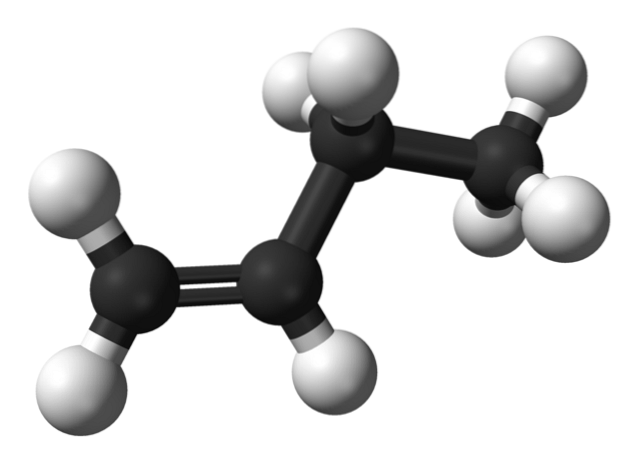
Men hva er isomerene av buten? I det øvre bildet er strukturen representert med hvite (hydrogener) og svarte (karbon) kuler for 1-buten. 1-buten er den enkleste isomeren av hydrokarbonet C4H8. Merk at det er åtte hvite kuler og fire svarte kuler, som stemmer overens med den kjemiske formelen.
De tre andre isomerer er cis og trans 2-Butene og iso-Butene. Alle av dem har svært like kjemiske egenskaper, selv om strukturene deres forårsaker variasjoner i fysiske egenskaper (smelte- og kokepunkter, tettheter osv.). Også IR-spektrene deres har lignende mønstre av absorpsjonsbånd..
I det vanlige blir 1-Butene kalt buten, selv om 1-Butene bare refererer til en enkelt isomer og ikke til et generisk navn. Disse fire organiske forbindelsene er gasser, men de kan flyte ved høyt trykk eller kondensere (og til og med krystallisere) med en reduksjon i temperaturen..
De er en kilde til varme og energi, reagenser for syntese av andre organiske forbindelser og fremfor alt nødvendig for fremstilling av kunstig gummi etter syntesen av butadien..
Artikkelindeks
- 1 Kjennetegn ved buten
- 1.1 Molekylvekt
- 1.2 Fysiske aspekter
- 1.3 Kokepunkt
- 1.4 Smeltepunkt
- 1.5 Løselighet
- 1.6 Tetthet
- 1.7 Reaktivitet
- 2 Kjemisk struktur
- 2.1 Konstitusjonelle og geometriske isomerer
- 2.2 Stabilitet
- 2.3 Intermolekylære krefter
- 3 bruksområder
- 4 Referanser
Butene egenskaper
Molekylær vekt
56,106 g / mol. Denne vekten er den samme for alle isomerer med formel C4H8.
Fysiske aspekter
Det er en fargeløs og brennbar gass (som de andre isomerer), og har en relativt aromatisk lukt..
Kokepunkt
Kokepunktene for isomerene av buten er som følger:
1-buten: -6ºC
Cis-2-Butene: 3,7 ºC
Trans-2-buten: 0,96 ºC
2-metylpropen: -6,9 ° C
Smeltepunkt
1-buten: -185,3 ºC
Cis-2-buten: -138,9 ºC
Trans-2-buten: -105,5 ° C
2-metylpropen: -140,4 ° C
Løselighet
Buten er veldig uoppløselig i vann på grunn av sin ikke-polære natur. Imidlertid oppløses den perfekt i noen alkoholer, benzen, toluen og etere..
Tetthet
0,577 ved 25 ° C Derfor er den mindre tett enn vann, og i en beholder vil den være plassert over den..
Reaktivitet
Som ethvert alken er dens dobbeltbinding utsatt for tilsetning av molekyler eller oksidering. Dette gjør buten og dets isomerer reaktive. På den annen side er de brennbare stoffer, så når de blir overopphetet reagerer de med oksygenet i luften..
Kjemisk struktur
I det øvre bildet er strukturen til 1-Butene representert. Til venstre kan du se plasseringen av dobbeltbindingen mellom første og andre karbon. Molekylet har en lineær struktur, selv om regionen rundt C = C-bindingen er flat på grunn av sp-hybridiseringto av disse karbonene.
Hvis 1-buten-molekylet ble rotert i en vinkel på 180 °, ville det ha det samme molekylet uten tilsynelatende endringer, og derfor mangler det optisk aktivitet.
Hvordan ville molekylene samhandle? C-H, C = C og C-C bindinger er apolare i naturen, så ingen av dem samarbeider om dannelsen av et dipolmoment. Følgelig er molekylene CHto= CHCHtoCH3 må samhandle ved hjelp av spredningsstyrker i London.
Den høyre enden av buten danner øyeblikkelige dipoler, som på kort avstand polariserer tilstøtende atomer i et nabomolekyl. Den venstre enden av C = C-bindingen vekselvirker på sin side ved å legge π-skyene oppå hverandre (som to plater eller ark).
Fordi det er fire karbonatomer som utgjør molekylskjelettet, er deres interaksjoner knapt nok til at væskefasen har et kokepunkt på -6 ° C..
Konstitusjonelle og geometriske isomerer
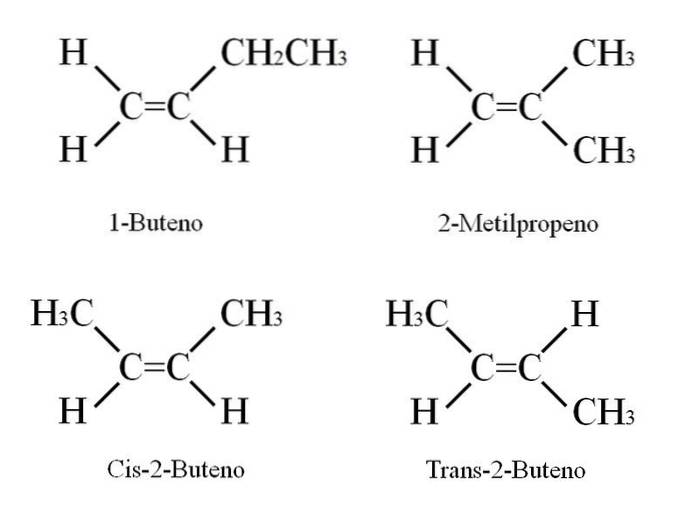
1-buten har molekylformelen C4H8; Imidlertid kan andre forbindelser ha samme andel av C- og H-atomer i strukturen..
Hvordan er det mulig? Hvis strukturen til 1-buten blir nøye observert, kan substituentene på C = C-karbonene byttes ut. Denne utvekslingen produserer andre forbindelser fra samme skjelett. I tillegg kan posisjonen til dobbeltbindingen mellom C-1 og C-2 skifte mot C-2 og C-3: CH3CH = CHCH3, 2-Butene.
I 2-buten kan H-atomene være lokalisert på samme side av dobbeltbindingen, som tilsvarer cis-stereoisomeren; eller i motsatt romlig orientering, i trans-stereoisomeren. Begge deler utgjør det som også kalles geometriske isomerer. Det samme gjelder for -CH grupper3.
Legg også merke til at hvis det ble igjen i CH-molekylet3CH = CHCH3 H-atomene på den ene siden, og CH-gruppene3 i en annen ville en konstitusjonell isomer oppnås: CHto= C (CH3)to, 2-metylpropen (også kjent som isobuten).
Disse fire forbindelsene har samme formel C4H8 men forskjellige strukturer. 1-buten og 2-metylpropen er konstitusjonelle isomerer; og cis og trans-2-Butene, geometriske isomerer mellom dem to (og konstitusjonelle med hensyn til resten).
Stabilitet
Forbrenningsvarme
Fra bildet over, hvilken av de fire isomerer representerer den mest stabile strukturen? Svaret finnes for eksempel i forbrenningsvarmen til hver av dem. Ved å reagere med oksygen, er isomeren med formel C4H8 blir til COto slipper vann og varme:
C4H8(g) + 6Oto(g) => 4COto(g) + 4HtoO (g)
Forbrenningen er eksoterm, så jo mer varme frigjøres, jo mer ustabil hydrokarbon. Derfor vil den av de fire isomerer som frigjør minst varme når du brenner i luft være den mest stabile..
Forbrenningsvarmene for de fire isomerer er:
-1-buten: 2717 kJ / mol
-cis-2-Butene: 2710 kJ / mol
-trans-2-buten: 2707 kJ / mol
-2-metylpropen: 2700 kJ / mol
Merk at 2-metylpropen er isomeren som gir minst mulig varme. Mens 1-Butene er den som frigjør mer varme, noe som gir større ustabilitet.
Sterisk og elektronisk effekt
Denne forskjellen i stabilitet mellom isomerer kan utledes direkte fra den kjemiske strukturen. I følge alkenene får den som har flere R-substituenter større stabilisering av sin dobbeltbinding. Dermed er 1-Butene den mest ustabile fordi den neppe har en substituent (-CHtoCH3); det vil si at den er monosubstituert (RHC = CHto).
Cis- og trans-isomerer av 2-buten er forskjellige i energi på grunn av Van der Wall-stress forårsaket av den steriske effekten. I cis-isomeren er de to CH-gruppene3 på samme side av dobbeltbindingen frastøter de hverandre, mens de i trans-isomeren er langt nok borte fra hverandre.
Men hvorfor er 2-metylpropen den mest stabile isomeren? Fordi den elektroniske effekten griper inn.
I dette tilfellet, selv om det er et disubstituert alken, de to CH-gruppene3 de er på samme karbon; i geminal posisjon i forhold til hverandre. Disse gruppene stabiliserer karbonet i dobbeltbindingen, noe som gir den en del av sin elektronsky (siden det er relativt surere på grunn av sp-hybridisering).to).
Videre har de to isomerer i 2-Butene bare 2º karbon; mens 2-metylpropen inneholder et tredje karbon, med større elektronisk stabilitet.
Intermolekylære krefter
Stabiliteten til de fire isomerene følger en logisk rekkefølge, men de intermolekylære kreftene gjør det ikke. Hvis deres smelte- og kokepunkt sammenlignes, vil det bli funnet at de ikke adlyder samme ordre.
Det ville forventes at trans-2-buten ville presentere de høyeste intermolekylære kreftene på grunn av større overflatekontakt mellom to molekyler, i motsetning til cis-2-buten, hvis skjelett trekker en C. Imidlertid koker cis-2-buten ved høyere temperatur (3,7 ° C), enn trans-isomeren (0,96 ° C).
Lignende kokepunkter for 1-buten og 2-metylpropen kan forventes fordi de strukturelt sett er veldig like. Imidlertid endres forskjellen radikalt i fast tilstand. 1-buten smelter ved -185,3 ° C, mens 2-metylpropen ved -140,4 ° C.
I tillegg smelter cis-2-buten-isomeren ved -138,9 ° C, ved en temperatur nær 2-metylpropenom, noe som kan bety at de i det faste stoffet har et like stabilt arrangement.
Fra disse dataene kan det konkluderes med at, til tross for at de kjenner de mest stabile strukturene, kaster de ikke nok lys over kunnskapen om hvordan intermolekylære krefter fungerer i væsken; og enda mer, i den faste fasen av disse isomerer.
applikasjoner
-Butener, gitt deres forbrenningsvarme, kan ganske enkelt brukes som en varmekilde eller drivstoff. Dermed ville 1-Butene-flammen forventes å varme opp mer enn de andre isomerer..
-Kan brukes som organiske løsningsmidler.
-De tjener som tilsetningsstoffer for å øke oktaninnholdet i bensin.
-Innen organisk syntese deltar 1-buten i produksjonen av andre forbindelser som: butylenoksid, 2-glutanol, succinimid og tert-butylmecaptan (brukes til å gi kokegass sin karakteristiske lukt). Likeledes butadien (CHto= CH-CH = CHto), hvorfra kunstig gummi blir syntetisert.
Utover disse syntesene vil mangfoldet av produktene avhenge av hvilke molekyler som tilsettes dobbeltbindingen. For eksempel kan alkylhalogenider syntetiseres hvis de reageres med halogener; alkoholer, hvis de tilfører vann i et surt medium; og tert-butylestere hvis de tilfører alkoholer med lav molekylvekt (for eksempel metanol).
Referanser
- Francis A. Carey. Organisk kjemi. Karboksylsyrer. (sjette utg., side 863-866). Mc Graw Hill.
- Wikipedia. (2018). Butene Hentet fra: es.wikipedia.org
- YPF. (Juli 2017). Buten oss. [PDF]. Hentet fra: ypf.com
- William Reusch. (5. mai 2013). Tilleggsreaksjoner fra Alkenes. Gjenopprettet fra: 2.chemistry.msu.edu
- PubChem. (2018). 1-Butene. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov

Ingen har kommentert denne artikkelen ennå.