
Dimetylanilinstruktur, egenskaper, syntese, bruksområder

De dimetylanilin eller dimetylfenylamin er en organisk forbindelse som dannes av en benzenring med en aminogruppe substituert med to metylgrupper. Dens kjemiske formel er C8HelleveN.
Det er også kjent som N, N-dimetylanilin, da det er et derivat av anilin der hydrogenene i aminogruppen er erstattet av to metylgrupper. Dette gjør det til et tertiært amin.
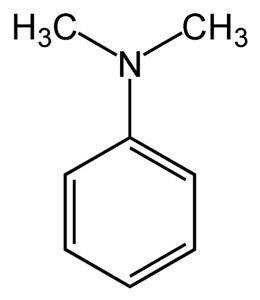
N, N-dimetylanilin er en lysegul til brun oljeaktig væske med den karakteristiske lukten fra aminer. Det er en basisk forbindelse og reagerer med salpetersyre for å danne en nitrosoforbindelse. Når den utsettes for luft, blir den brun.
Den brukes til fremstilling av fargestoffer for maling. Den brukes også som en aktivator for polymeriseringskatalysatorer og i blandinger som brukes til bildeopptak. I sin tur har den blitt brukt i syntesen av antibakterielle eller antibiotiske forbindelser som visse penicillin-avledede cefalosporiner. N, N-dimetylanilin er også en base for å oppnå andre kjemiske forbindelser.
Det er en brennbar væske og avgir giftig røyk ved oppvarming til nedbrytning. Akutt eksponering av mennesker for N, N-dimetylanilin kan føre til negative effekter som hodepine, svimmelhet, redusert oksygen i blodet og blåaktig misfarging av huden, blant andre symptomer..
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Kokepunkt
- 3.5 Flammepunkt
- 3.6 Damptrykk
- 3.7 Selvantennelsestemperatur
- 3,8 Tetthet
- 3.9 Brytningsindeks
- 3.10 Løselighet
- 3.11 Grunnleggende konstant
- 3.12 Kjemiske egenskaper
- 3.13 Risiko
- 4 Syntese
- 5 bruksområder
- 5.1 I fargestoffindustrien
- 5.2 Ved fremstilling av lysherdende blandinger
- 5.3 I glassfiberproduksjon
- 5.4 I syntesen av antibiotika
- 5.5 I katalyse av kjemiske reaksjoner
- 5.6 I forskjellige applikasjoner
- 6 Referanser
Struktur
Følgende figur viser den romlige strukturen til N, N-dimetylanilin:
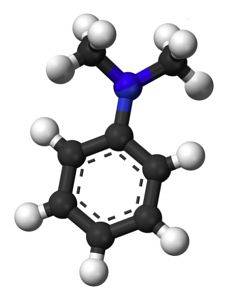
Nomenklatur
- N, N-dimetylanilin
- Dimetylanilin
- Dimetylfenylamin
- N, N-dimetylbenzenamin
N, N plasseres i navnet for å indikere at de to metylgruppene (-CH3er festet til nitrogen (N) og ikke til benzenringen.
Eiendommer
Fysisk tilstand
Lysegul til brun væske.
Molekylær vekt
121,18 g / mol.
Smeltepunkt
3 ºC.
Kokepunkt
194 ºC.
Flashpoint
63 ºC (lukket koppmetode). Det er minimumstemperaturen der den avgir damp som kan antennes hvis en flamme føres over den..
Damptrykk
0,70 mm Hg ved 25 ºC.
Selvantennelsestemperatur
371 ° C. Det er minimumstemperaturen der den brenner spontant ved atmosfæretrykk, uten en ekstern kilde til varme eller flamme..
Tetthet
0,9537 g / cm3 ved 20 ºC.
Brytningsindeks
1,5582 ved 20 ºC.
Løselighet
I vann er det veldig lett løselig: 1,454 mg / l ved 25 ºC.
Fritt løselig i alkohol, kloroform og eter. Løselig i aceton, benzen og oksygenerte og klorerte løsningsmidler.
Grunnleggende konstant
Kb 11.7, som indikerer hvor lett denne forbindelsen aksepterer et hydrogenion fra vann.
Kjemiske egenskaper
N, N-dimetylanilin er en basisk forbindelse. Reagerer med eddiksyre for å gi N, N-dimetylaniliniumacetat.
Gruppen -N (CH3)to av N, N-dimetylanilin er en kraftig aktivator for aromatisk substitusjon ved stillingen for å av benzenringen.
Reagerer med natriumnitritt (NaNOtoi nærvær av saltsyre (HCl) som danner p-nitroso-N, N-dimetylanilin. Også med salpetersyre genererer den samme nitroserte forbindelsen i posisjon for å.
Når N, N-dimetylanilin reagerer med benzenediazoniumklorid, i et mildt surt medium, produseres en azoforbindelse av typen Ar-N = N-Ar ', hvor Ar er en aromatisk gruppe. Molekyler med azogrupper er sterkt fargede forbindelser.
Risiko
Ved oppvarming til nedbrytning avgir den meget giftige anilindampe og nitrogenoksider NOx.
Det er en brennbar væske.
Den nedbrytes sakte i vann som er utsatt for sollys. Nedbrytes ikke.
Den flyktiggjøres fra våt jord og vannoverflater. Den fordamper ikke fra tørr jord og beveger seg gjennom den. Akkumuleres ikke i fisk.
Det kan absorberes gjennom huden. Det absorberes også raskt ved innånding. Menneskelig eksponering for N, N-dimetylanilin kan redusere oksygeninnholdet i blodet, noe som resulterer i en blåaktig hudfarge..
Akutt innånding av denne forbindelsen kan føre til negative effekter på sentralnervesystemet og sirkulasjonssystemet, med hodepine, cyanose og svimmelhet..
Syntese
Den kan produseres på flere måter:
- Fra anilin og metanol under trykk i nærvær av syrekatalysatorer, slik som HtoSW4. Det oppnås sulfat som omdannes til basen ved tilsetning av natriumhydroksyd.
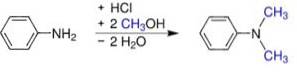
- Passerer en anilindamp og dimetyleter over aktivert aluminiumoksid.
- Oppvarming av en blanding av anilin, aniliniumklorid og metanol under trykk og deretter destillering.
applikasjoner
I fargestoffindustrien
På grunn av egenskapen til å reagere med benzenediazoniumklorid for å danne azoforbindelser, brukes N, N-dimetylanilin som et mellomprodukt ved fremstilling av fargestoffer..
Det er et råstoff i syntesen av fargestoffene i metylfiolettfamilien.
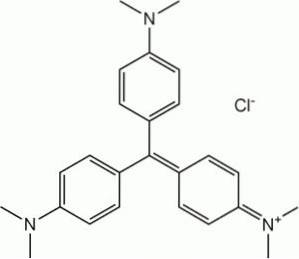
Ved fremstilling av lysherdende blandinger
N, N-dimetylanilin er en del av en lysherdende blanding som gjennomgår herdingsreaksjonen som et resultat av høy følsomhet for synlig eller nær infrarødt lys, slik at den kan brukes til bilderegistrering eller fotoresistmaterialer..
N, N-dimetylanilin er en av komponentene i blandingen som forårsaker sensibilisering for bølgelengder, på en slik måte at sammensetningen herdes med lys med lave energibølgelengder.
Det anslås at rollen til N, N-dimetylanilin sannsynligvis vil undertrykke den radikale polymerisasjonsavslutningsreaksjonen forårsaket av oksygen..
I glassfiberproduksjon
N, N-dimetylanilin brukes som katalytisk herder i visse glassfiberharpikser.
I syntesen av antibiotika
N, N-dimetylanilin deltar i syntesen av cefalosporiner fra penicilliner.
Penicillinsulfoksider omdannes til cefemderivater når de varmes opp i nærvær av basiske katalysatorer som N, N-dimetylanilin.
Disse cefalosporinene har antibakteriell aktivitet mot gram-positive og gram-negative organismer, så vel som mot penicillinresistente stafylokokker..
Det skal imidlertid bemerkes at N, N-dimetylanilin forblir i disse antibiotika som en urenhet..
I katalyse av kjemiske reaksjoner
N, N-dimetylanilin brukes til aktivering av olefinpolymerisasjonskatalysatorer.
Det brukes sammen med pentafluorfenol (C6F5OH) som den danner den ioniske forbindelsen [HNPhMeto]+[H (OC6F5)to]-. Denne ioniske forbindelsen har en eller to aktive protoner som aktiverer katalysatoren basert på et overgangsmetall.
I tillegg har N, N-dimetylanilin ved fremstilling av harpikser blitt brukt som en polymerisasjonsakselerator eller promoter for dannelse av polyesterharpikser. Dens handlinger genererer en rask herding av harpiksen.
I forskjellige applikasjoner
Den brukes i syntesen av andre kjemiske forbindelser, for eksempel vanillin, og som et mellomprodukt for farmasøytiske legemidler.
Det brukes også som et løsningsmiddel, som et alkyleringsmiddel, som en stabilisator, og for å lage maling og belegg..
Referanser
- S. National Library of Medicine. (2019). N, N-dimetylanilin. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Morrison, R.T. og Boyd, R.N. (2002). Organisk kjemi. 6. utgave. Prentice-Hall.
- (2000). N, N-dimetylanilin. Sammendrag. Gjenopprettet fra epa.gov
- Zanaboni, P. (1966). Umettet polyesterharpiksblanding med høy stabilitet og rask herding ved lave temperaturer ved bruk av en blanding av dimetylanilin, trietanolamin og difenylamin. OSS. Patent nr. 3 236 915. 22. februar 1966.
- Nudelman, A. og McCaully, R.J. (1977). Fremgangsmåte for omorganisering av penicilliner til cefalosporiner og mellomprodukter derav. OSS. Patent nr. 4,010,156. 1. mars 1977.
- Kouji Inaishi (2001). Fotoherdbar sammensetning. OSS. Patent nr. 6 171 759 B1. 9. januar 2001.
- Luo, L. et al. (2012). Jonisk bronsyre. OSS. Patent nr. 8088952 B2. 3. januar 2012.

Ingen har kommentert denne artikkelen ennå.