
Natriumcyanid (NaCN) struktur, egenskaper, risiko, bruksområder

De Natriumcyanid er et uorganisk salt dannet av en natriumkation Na+ og et cyanidanion CN-. Den kjemiske formelen er NaCN. Også kjent som natriumcyanid, det er et hvitt krystallinsk fast stoff. Det er hygroskopisk, det vil si at det absorberer vann fra miljøet, og dets krystaller er kubiske som natriumklorid NaCl.
Når det er oppløst i vann, har det en tendens til å danne hydrogencyanid HCN. Dens løsninger oppløser lett gull og sølv. Denne egenskapen gjør at den brukes til å utvinne gull og sølv fra mineralene. Løsningene som brukes til dette formålet resirkuleres, det vil si at de brukes på nytt flere ganger.

Imidlertid klarer noe av cyanidet å unnslippe til visse avfallsdammer, noe som representerer en fare for dyrelivet og for mennesker, ettersom cyanid er veldig giftig og kan forårsake død..
NaCN brukes i den kjemiske industrien som et mellomprodukt for å fremstille forskjellige typer forbindelser, som fargestoffer, landbrukskjemikalier og medisiner eller medisiner..
Sodium cyanide er en veldig farlig forbindelse da det kan forårsake død, så det må håndteres med ekstrem forsiktighet.
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Kokepunkt
- 3.5 Flammepunkt
- 3.6 Tetthet
- 3.7 Løselighet
- 3.8 Dissosiasjonskonstant
- 3,9 pH
- 3.10 Kjemiske egenskaper
- 4 Risiko
- 5 Motta
- 6 bruksområder
- 6.1 Ved utvinning av gull- og sølvmineraler. Konsekvenser
- 6.2 Ved produksjon av andre kjemiske forbindelser
- 6.3 I metallindustrien
- 6.4 I andre bruksområder
- 6.5 Uten bruk, spørsmål eller svært sjeldne bruksområder
- 7 Referanser
Struktur
Sodium cyanide består av et Na + -ion og et CN-ion-.
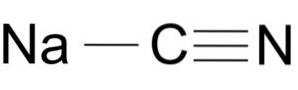
Cyanidionet har et karbonatom C og et nitrogenatom N bundet til hverandre ved en trippelbinding..
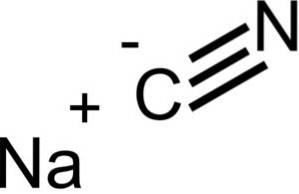
NaCN har samme krystallinske struktur som NaCl, så krystallene er kubiske.
Nomenklatur
-Natriumcyanid
-Natriumcyanid
Eiendommer
Fysisk tilstand
Hygroskopisk hvitt krystallinsk fast stoff (absorberer vann fra miljøet).
Molekylær vekt
49,007 g / mol
Smeltepunkt
563,7 ºC
Kokepunkt
1496 ºC
Flashpoint
Det er ikke brannfarlig. Men hvis de utsettes for brann, blir HCN hydrogencyanid og nitrogenoksider produsert..
Tetthet
1.595 g / cm3 ved 20 ºC
Løselighet
Svært løselig i vann: 48 g / 100 ml ved 10 ° C, 82 g / 100 ml ved 35 ° C. Litt løselig i alkohol
Dissosiasjonskonstant
Den hydrolyseres i vandig løsning som genererer hydrogencyanid HCN. Konstanten til denne hydrolysen er Kh = 2,5 x 10-5.
pH
Vandige NaCN-løsninger er sterkt basiske
Kjemiske egenskaper
Når den er oppløst i vann, skiller den seg inn i Na-ionene+ og CN-. I vandig løsning cyanidionet CN- ta et proton H+ vann HtoEller danner HCN og et OH-ion-, slik at løsningen blir alkalisk.
CN- + HtoO → HCN + OH-
Av denne grunn nedbrytes de vandige løsningene raskt når de lagres, og danner hydrogencyanid HCN..
Det er etsende mot aluminium. Dens løsninger oppløser lett gull Au og sølv Ag i nærvær av luft..
Det er et chelateringsmiddel siden cyanidanionen CN- kan lett binde seg til andre metaller, som sølv, gull, kvikksølv, sink, kadmium, etc..
Har en svak bitter mandellukt.
Risiko
Det må håndteres med stor forsiktighet. Det er en svært giftig forbindelse, hemmer viktige metabolske prosesser og fører til døden ved svelging, innånding, absorpsjon gjennom huden eller kontakt med øynene..
Ved innånding oppløses NaCN i slimhinnen i luftveiene og går over i blodet. Cyanidionet av NaCN har en sterk affinitet for jern i oksidasjonstilstanden på +3, det vil si ferrikation Fe3+.
Når cyanid absorberes, reagerer det raskt med Fe3+ av et viktig enzym i mitokondriene i cellene (cytokromoksidase), og forhindrer visse prosesser for åndedrett av dette.
Derfor inhiberes eller reduseres cellulær respirasjon, og det resulterer i cytotoksisk hypoksi. Det betyr at celler og vev ikke er i stand til å bruke oksygen, spesielt hjerne- og hjerteceller.
På denne måten oppstår permanent eller dødelig skade på kroppen. Dette kan forekomme hos både mennesker og dyr..
Ved inntak forårsaker det lunger i blodkarene og korrosjon i mageslimhinnen, i tillegg til det nevnte.

Det er ikke brennbart, men i kontakt med syrer frigjør det HCN som er svært brannfarlig og giftig.
Hvis den smelter med nitritter eller klorater, kan den eksplodere.
Å skaffe
Kan fås med natrium Na, ammoniakk NH3 og karbon C. Natrium reagerer med ammoniakk for å gi natriumamid NaNHto:
2 Na + 2 NH3 → 2 NaNHto + Hto↑
Sodiumamid oppvarmes med kull til 600 ° C og produserer natriumcyanamid NatoNCN, som deretter omdannes til natriumcyanid med kull ved 800 ºC:
2 NaNHto + C → 2 Hto↑ + NatoNCN
NatoNCN + C → 2 NaCN
En annen metode er å smelte kalsiumcyanamid CaNCN og karbon C med natriumkarbonat NatoCO3:
CaNCN + C + NatoCO3 → CaCO3 + 2 NaCN
Det kan også fremstilles ved å føre nitrogengass Nto ved en varm blanding av natriumkarbonat NatoCO3 og pulverisert karbon C, med jern Fe som katalysator eller reaksjonsakselerator:
NatoCO3 + 4 C + N.to → 2 NaCN + 3 CO ↑
applikasjoner
Ved utvinning av gull- og sølvmineraler. Konsekvenser
Natriumcyanid har lenge vært brukt til å utvinne metallene gull og sølv fra malmen..
Cyanidet som brukes i prosessen resirkuleres, men noe rømmer ut i avfallsdammen sammen med de ikke gjenopprettede tungmetallene.
Fugler, flaggermus og andre dyr som drikker fra disse cyanidlagunene er blitt forgiftet.
Det er registrert en dam i Romania som isolerte en søppeldam og ble skadet av en værhendelse..
Som en konsekvens ble tonnevis av cyanid sluppet ut i Sasar-elven og nærliggende akvifersystemer som elvene Lapus, Somes og Tisza, og endte i Donau..
Dette forårsaket en kaskade av dyredødsfall, eller med andre ord en økologisk katastrofe..

Ved produksjon av andre kjemiske forbindelser
NaCN natriumcyanid brukes i syntesen av forskjellige typer organiske forbindelser.
For eksempel fremstilles pigmenter og fargestoffer (inkludert optiske lysemidler), forbindelser for bruk i jordbruk eller landbrukskjemikalier og forskjellige legemidler..
Det brukes også til å oppnå chelaterings- eller sekvestreringsmidler for metallioner..
Forbindelser kalt nitriler fremstilles med natriumcyanid NaCN, som når det behandles med varm sur eller alkalisk vandig oppløsning, gir karboksylsyrer.
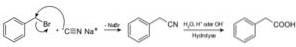
Det gjør det mulig å fremstille fettsyrer med cyanogrupper, tungmetallcyanider og hydrocyansyre eller HCN hydrogencyanid.
I metallindustrien
NaCN brukes i løsninger som brukes til galvanisering eller galvanisering av metaller (belegg av metaller med andre), for eksempel sink.
Det er en komponent av herdet stål. Serverer også metallrengjøring.
I andre bruksområder
Sodium cyanide er et mellomprodukt i produksjonen av nylon.
Serverer for separering av mineraler ved skumflotasjon.
Applikasjoner ute av bruk, spørsmålstegn ved eller svært sjeldne
NaCN ble brukt til å drepe gnagere, som kaniner og rotter, og deres huler, og for å drepe termitt reir.
For tiden brukes den av og til for å eliminere coyoter, rev og ville hunder. Brukes i kapselform som enkeltdoser eller flere doser på landområder, jaktområder og skoger.
På grunn av sin ekstreme toksisitet, bør NaCN kun brukes av trente personer..
Denne bruken anses som veldig farlig for mennesker, men det er de som fortsatt bruker den.

I landbruket ble det tidligere brukt til å fukte sitrusfrukttrær og annen frukt. Det ble også brukt som insektmiddel og miticid (middeliminator) som skal påføres etter høsting, for sitrusfrukter som ikke er lagret eller for gassing av lastebiler som brukes til å transportere dem. Det ble også brukt til å rense skip, jernbanevogner og lager..
Alle disse bruksområdene har blitt stilt spørsmålstegn på grunn av den høye toksisiteten til natriumcyanid. Av denne grunn brukes den ikke lenger eller bare veldig sjelden og under veldig kontrollerte forhold..
Referanser
- OSS. National Library of Medicine. (2019). Natriumcyanid. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fjerde utgave. John Wiley & Sons.
- Hurst, H.E. og Martin, M.D. (2017). Toksikologi. Cyanid. In Pharmacology and Therapeutics for Dentistry (Seventh Edition). Gjenopprettet fra sciencedirect.com.
- Coppock, R.W. og Dziwenka, M. (2015). Trusler mot dyrelivet av Chemical Warfare Agents. I Handbook of Toxicology of Chemical Warfare Agents (Second Edition). Gjenopprettet fra sciencedirect.com.
- Morrison, R.T. og Boyd, R.N. (2002). Organisk kjemi. 6. utgave. Prentice-Hall.


Ingen har kommentert denne artikkelen ennå.