
Sykloalkiner, egenskaper, bruksområder, eksempler
De sykloalkiner De er organiske forbindelser som har en eller flere trippelbindinger og en syklisk enhet. Dens kondenserte molekylformler overholder formelen CnH2n-4. Således, hvis n er lik 3, vil formelen til cykloalkinen være C3Hto.
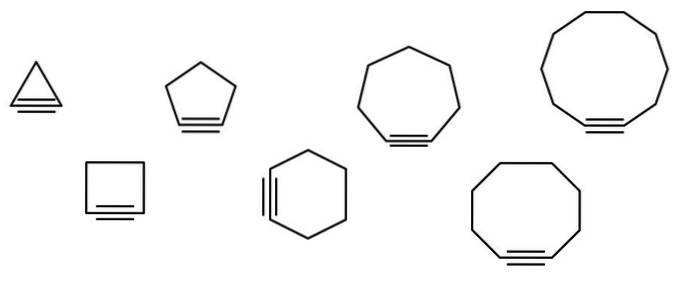
En serie geometriske figurer er illustrert i bildet nedenfor, men de består faktisk av eksempler på cykloalkiner. Hver av dem kan betraktes som en mer oksidert versjon av de respektive cykloalkanene (uten dobbelt- eller trippelbindinger). Når de mangler heteroatom (O, N, S, F, etc.), er de bare "enkle" hydrokarboner..
Kjemien rundt cykloalkiner er veldig kompleks, og mekanismene bak reaksjonene deres er enda mer komplekse. De representerer et utgangspunkt for syntesen av mange organiske forbindelser, som igjen er gjenstand for mulige anvendelser.
Generelt sett er de svært reaktive med mindre de er "forvrengt" eller sammensatt med overgangsmetaller. På samme måte kan dens trippelbindinger konjugeres med dobbeltbindinger, og skape sykliske enheter i molekylene..
Hvis dette ikke er tilfelle, er de i sine enkleste strukturer i stand til å tilsette små molekyler til deres trippelbindinger..
Artikkelindeks
- 1 Kjennetegn ved sykloalkiner
- 1.1 Apolaritet og trippelbinding
- 1.2 Intermolekylære krefter
- 1.3 Vinkelspenning
- 2 Nomenklatur
- 3 applikasjoner
- 4 Eksempler
- 5 Referanser
Kjennetegn ved sykloalkiner
Apolaritet og trippelbåndet
Sykloalkiner er preget av å være apolare molekyler, og derfor hydrofobe. Dette kan endre seg hvis de i strukturene har en heteroatom eller funksjonell gruppe som gir dem et betydelig dipolmoment; slik det skjer i heterosykler med trippelbindinger.
Men hva er et trippelbånd? De er ikke mer enn tre samtidige interaksjoner mellom to karbonatomer med sp-hybridisering. En binding er enkel (σ), og de andre to π, vinkelrett på hverandre. Begge karbonatomer har en fri sp-bane for å binde seg til andre atomer (R-C≡C-R).
Disse hybridorbitalene har 50% karakter og 50% karakter. Fordi s-orbitalene er mer gjennomtrengende enn p-ene, gjør dette faktum at de to karbonene i trippelbindingen er surere (elektronakseptorer) enn karbonene i alkanene eller alkenene..
Av denne grunn representerer trippelbindingen (≡) et spesifikt punkt for elektrondonearter å legge til seg, og danner enkeltbindinger..
Dette resulterer i at en av π-bindingene brytes, og blir en dobbeltbinding (C = C). Tillegget fortsetter til R4C-CR4, dvs. fullmettet karbon.
Ovennevnte kan også forklares på denne måten: trippelbindingen er en dobbelt umettethet.
Intermolekylære krefter
Sykloalkinmolekyler samhandler gjennom spredningskrefter eller London-krefter og ved interaksjoner av π-π-typen. Disse interaksjonene er svake, men når størrelsen på syklusene øker (som de tre siste på høyre side av bildet), klarer de å danne faste stoffer ved romtemperatur og trykk..
Vinkelt stress
Bindingene i trippelbindingen er plassert på samme plan og en linje. Derfor har -C≡C- en lineær geometri, med sp-orbitaler atskilt med omtrent 180º.
Dette har en alvorlig betydning for den stereokjemiske stabiliteten til cykloalkiner. Det tar mye energi å "bøye" sp-orbitalene siden de ikke er fleksible.
Jo mindre cykloalkinen er, desto mer må sp-orbitalene bøyes for å tillate den fysiske eksistensen. Når man analyserer bildet, kan man se, fra venstre til høyre, at i trekanten er vinkelen på bindingene til sidene av trippelbindingen veldig uttalt; mens de er i decagon er de mindre bratte.
Jo større cykloalkin, jo nærmere binder vinkelen til sp-orbitalene den ideelle 180 °. Det motsatte oppstår når de er mindre, og tvinger dem til å bøye seg og skape en vinkelstress i dem, destabiliserende cykloalkinen.
Dermed har de større cykloalkiner lavere vinkelspenning, noe som muliggjør deres syntese og lagring. Med dette er trekanten den mest ustabile cykloalkinen, og dekagonen den mest stabile av dem alle..
Egentlig er cyklooktinoen (den med åttekantet) den minste og mest stabile kjente størrelsen; de andre eksisterer bare som midlertidige mellomledd i kjemiske reaksjoner.
Nomenklatur
De samme IUPAC-standardene som for cykloalkaner og cykloalkener må brukes på navngivning av cykloalkiner. Den eneste forskjellen ligger i suffikset -ico på slutten av navnet på den organiske forbindelsen..
Hovedkjeden er den som har trippelbinding, og begynner å bli nummerert fra slutten nærmest den. Hvis du har for eksempel cyklopropan, vil det å ha en trippelbinding kalles cyclopropino (trekanten på bildet). Hvis en metylgruppe er festet til toppunktet, vil den være: 2-metylsyklopropino.
Kullene til R-C≡C-R har allerede sine fire bindinger, så det mangler hydrogener (som det er tilfelle med alle cykloalkiner på bildet). Dette skjer ikke bare hvis trippelbindingen er i en terminal posisjon, det vil si ved enden av en kjede (R-C≡C-H).
applikasjoner
Sykloalkiner er ikke veldig vanlige forbindelser, så heller ikke deres applikasjoner. De kan tjene som bindemidler (grupper som koordinerer) til overgangsmetaller, og dermed skape en uendelig mengde organometalliske forbindelser som kan brukes til meget strenge og spesifikke bruksområder..
De er vanligvis løsningsmidler i deres mest mettede og stabile former. Når de består av heterosykler, i tillegg til å ha interne C2C-C = C-C2C sykliske enheter, finner de interessante og lovende bruksområder som kreftmedisiner; Slik er tilfellet med Dinemycin A. Andre forbindelser med strukturelle analogier har blitt syntetisert fra den..
Eksempler
Bildet viser syv enkle cykloalkiner, hvor det knapt er en trippelbinding. Fra venstre til høyre, med deres respektive navn, er det: cyclopropino, trekanten; cyclobutino, torget; cyklopentin, pentagon; cykloheksin, sekskanten; cykloheptin, heptagonen; cyklooktino, åttekantet; og cyclodecino, dekagonet.
Basert på disse strukturene og erstatning av hydrogenatomene til de mettede karbonene, kan andre forbindelser avledet fra dem oppnås. De kan også bli utsatt for oksidative forhold for å generere dobbeltbindinger på andre sider av syklusene..
Disse geometriske enhetene kan være en del av en større struktur, noe som øker sjansene for å funksjonalisere hele settet. Det er ikke mange eksempler tilgjengelig på cykloalkiner, i det minste ikke uten å fordype seg i de dype områdene av organisk syntese og farmakologi..
Referanser
- Francis A. Carey. Organisk kjemi. (Sjette utgave, s. 372, 375). Mc Graw Hill.
- Wikipedia. (2018). Cycloalkyne. Hentet fra: en.wikipedia.org
- William Reusch. (5. mai 2013). Navngi organiske forbindelser. Hentet fra: 2.chemistry.msu.edu
- Uorganisk kjemi. Sykloalkiner. Hentet fra: fullquimica.com
- Patrizia Diana & Girolamo Cirrincione. (2015). Biosyntese av heterosykler fra isolasjon til genklynge. Wiley, side 181.
- Interessant organisk kjemi og naturlige produkter. (2015, 17. april). Sykloalkyner. Hentet fra: quintus.mickel.ch



Ingen har kommentert denne artikkelen ennå.