
Syklopentan (C5H10) struktur, egenskaper og bruksområder
De cyklopentan det er et syklisk hydrokarbon, spesielt en cykloalkan. I sin tur er det en organisk forbindelse hvis molekylformel er C5H10. Det kan sees på som den lukkede versjonen av n-pentan, åpen kjede, der endene har blitt forbundet med tapet av to hydrogenatomer.
Det nedre bildet viser skjelettet til cyklopentan. Legg merke til hvor geometrisk skjelettet ser ut og danne en femkantet ring. Imidlertid er dens molekylære struktur ikke flat, men presenterer heller bretter som søker å stabilisere og redusere spenningen i ringen. Syklopentan er en svært flyktig og brennbar væske, men ikke så brannfarlig som n-pentan.
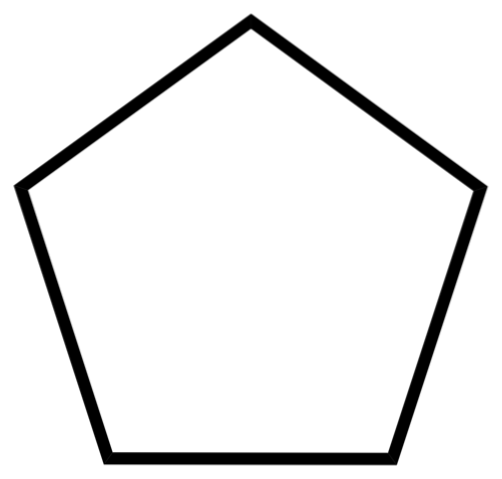
På grunn av løsemiddelkapasiteten er cyklopentan et av de mest brukte løsningsmidlene i den kjemiske industrien. Det er ikke overraskende at mange produkter med sterk lukt inneholder det blant deres sammensetning, og er derfor brannfarlig. Det brukes også som et blåsemiddel for polyuretanskum som brukes i kjøleskap..
Artikkelindeks
- 1 Struktur av syklipentan
- 1.1 Intermolekylære interaksjoner
- 1.2 Konformasjoner og ringspenning
- 2 Egenskaper av syklipentan
- 2.1 Fysisk utseende
- 2.2 Molarmasse
- 2.3 Smeltepunkt
- 2.4 Kokepunkt
- 2.5 Flammepunkt
- 2.6 Selvantennelsestemperatur
- 2.7 Fordampningsvarme
- 2.8 Viskositet
- 2.9 Brytningsindeks
- 2.10 Damptrykk
- 2.11 Tetthet
- 2.12 Løselighet
- 2.13 Fordelingskoeffisient for oktanol / vann
- 2.14 Reaktivitet
- 3 bruksområder
- 3.1 Industrielt løsemiddel
- 3.2 Etylenkilde
- 3.3 Isolerende polyuretanskum
- 4 Referanser
Struktur av syklipentan
Intermolekylære interaksjoner
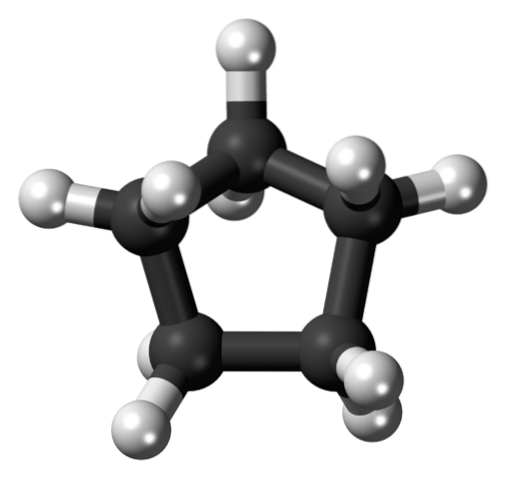
På det første bildet ble cyklopentanskjelettet vist. Ovenfor ser vi nå at det er mer enn en enkel femkant: hydrogenatomer (hvite sfærer) stikker ut ved kantene, mens karbonatomer utgjør den femkantede ringen (svarte sfærer).
Ved å kun ha C-C og C-H-bindinger er deres dipolmoment ubetydelig, slik at cyklopentanmolekyler ikke kan samhandle med hverandre gjennom dipol-dipolkrefter. I stedet blir de holdt sammen takket være Londons spredte krefter, med ringene som prøver å stable hverandre..
Denne stablingen gir noe kontaktareal større enn det som er tilgjengelig mellom lineære molekyler av n-pentan. Som et resultat av dette har cyklopentan et høyere kokepunkt enn n-pentan, samt et lavere damptrykk.
Dispergeringskrefter er ansvarlige for at cyklopentan danner en molekylær krystall når den er frossen ved -94 ° C. Selv om det ikke er mye informasjon om dens krystallinske struktur, er den polymorf og har tre faser: I, II og III, med fase II som en uordnet blanding av I og III.
Konformasjoner og ringspenning
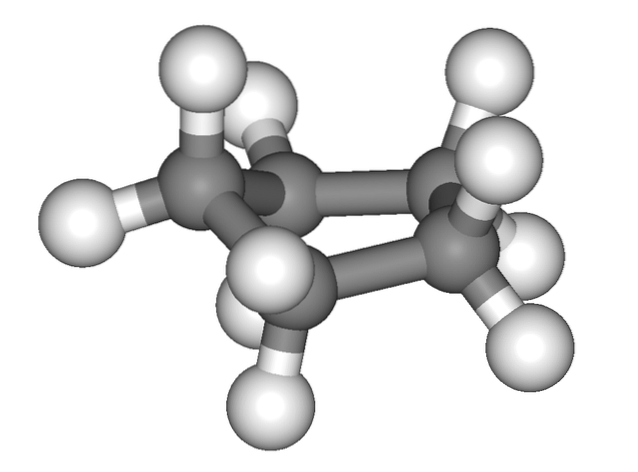
Bildet over gir feilaktig inntrykk av at cyklopentan er flat; men det er ikke sånn. Alle karbonatomer har sp-hybridisering3, så deres orbitaler er ikke i samme plan. Også, som om dette ikke var nok, er hydrogenatomene veldig nær hverandre, kraftig frastøtt når de blir formørket..
Dermed snakker vi om konformasjoner, en av dem er halvstolen (toppbilde). Fra dette perspektivet forstås det tydelig at cyklopentanringen har bøyninger, noe som bidrar til å redusere ringspenningen på grunn av karbonatomer så nær hverandre..
Denne spenningen skyldes det faktum at C-C bindinger har vinkler mindre enn 109,5 º, den ideelle verdien for tetraedrisk miljø som et resultat av deres sp hybridiseringer.3.
Til tross for denne belastningen er cyklopentan imidlertid en mer stabil og mindre brennbar forbindelse enn pentan. Dette kan verifiseres ved å sammenligne deres sikkerhetsdiamanter, der brennbarheten til cyklopentan er 3, mens den for pentan, 4.
Egenskaper av cyclipentane
Fysisk utseende
Fargeløs væske med en mild petroleumlignende lukt.
Molarmasse
70,1 g / mol
Smeltepunkt
-93,9 ºC
Kokepunkt
49,2 ºC
Flammepunkt
-37,2 ºC
Selvantennelsestemperatur
361 ºC
Fordampningsvarme
28,52 kJ / mol ved 25 ºC
Viskositet
0,413 mPa s
Brytningsindeks
1.4065
Damptrykk
45 kPa ved 20 ° C. Dette trykket tilsvarer omtrent 440 atm, men lavere enn det for n-Pentan: 57,90 kPa.
Her manifesteres effekten av strukturen: cyklopentanringen tillater mer effektive intermolekylære interaksjoner, som binder og beholder flere molekyler i væsken sammenlignet med de lineære molekylene i n-pentan. Derfor har sistnevnte et høyere damptrykk.
Tetthet
0,751 g / cm3 ved 20 ° C. På den annen side er dampene 2,42 ganger tettere enn luft.
Løselighet
I en liter vann ved 25 ° C oppløses bare 156 mg cyklopentan på grunn av dens hydrofobe natur. Imidlertid er det blandbart i ikke-polære løsningsmidler som andre parafiner, etere, benzen, karbontetraklorid, aceton og etanol..
Fordelingskoeffisient for oktanol / vann
3
Reaktivitet
Syklopentan er stabil når den lagres riktig. Det er ikke et reaktivt stoff fordi dets C-H og C-C bindinger ikke er lette å bryte, selv om det vil føre til frigjøring av energi forårsaket av spenningen i ringen.
I nærvær av oksygen vil det brenne i en forbrenningsreaksjon, det være seg fullstendig eller ufullstendig. Siden cyklopentan er en veldig flyktig forbindelse, må den lagres på steder der den ikke kan utsettes for noen varmekilde..
I mellomtiden, i mangel av oksygen, vil cyclopentan gjennomgå en pyrolysereaksjon, og spaltes til mindre og umettede molekyler. En av dem er 1-penten, som viser at varmen bryter cyklopentanringen for å produsere et alken.
På den annen side kan cyklopentan reagere med brom under ultrafiolett stråling. På denne måten erstattes en av dens C-H obligasjoner med C-Br, som igjen kan erstattes av andre grupper; og således dukker cyklopentanderivater opp.
applikasjoner
Industrielt løsemiddel
Den hydrofobe og apolære karakteren av cyklopentan gjør det til et avfettingsmiddel, sammen med andre parafiniske løsningsmidler. På grunn av dette er det vanligvis en del av formuleringene til mange produkter, som lim, syntetiske harpikser, maling, lim, tobakk og bensin..
Etylen kilde
Når cyklopentan utsettes for pyrolyse, er et av de viktigste stoffene det genererer etylen, som har utallige anvendelser i verden av polymerer..
Isolerende polyuretanskum
En av de mest bemerkelsesverdige anvendelsene av cyklopentan er som et blåsemiddel for fremstilling av isolerende polyuretanskum; det vil si cyklopentangasser på grunn av høyt trykk utvider det polymere materialet til det danner et skum med gunstige egenskaper som skal brukes i rammen av kjøleskap eller fryser.
Noen selskaper har valgt å erstatte syklopentan med HFC ved fremstilling av isolasjonsmaterialer, siden det ikke bidrar til forringelse av ozonlaget, og også reduserer utslipp av klimagass i miljøet..
Referanser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. (10th utgave.). Wiley pluss.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Wikipedia. (2020). Syklopentan. Gjenopprettet fra: en.wikipedia.org
- Nasjonalt senter for bioteknologisk informasjon. (2020). Syklopentan. PubChem Database, CID = 9253. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Syklopentan. ScienceDirect. Gjenopprettet fra: sciencedirect.com
- GE-apparater. (2011, 11. januar). Redusere klimagassutslipp ved GEs produksjonsanlegg for kjøleskap. Gjenopprettet fra: pressroom.geappliances.com



Ingen har kommentert denne artikkelen ennå.