
Hypojodsyre (HIO) formel, egenskaper og bruksområder

De hypojodsyre, også kjent som hydrogenmonoxoiodate (I) eller iodol, det er en uorganisk forbindelse med formel HIO. Det er et oksidsyre av jod, med et oksygenatom, et hydrogenatom og et jodatom med en oksidasjonstilstand på 1+.
Forbindelsen er veldig ustabil siden den har en tendens til å gjennomgå en dismutasjonsreaksjon der den reduseres til molekylært jod og oksyderes til jodsyre i henhold til reaksjonen: 5HIO → 2Ito + HIO3 + 2HtoELLER.
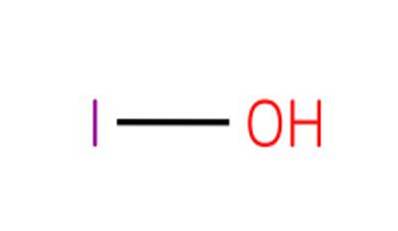
Forbindelsen er den svakeste syren i 1+ oksidasjonstilstanden halogenoksyrer. De tilsvarende saltene av denne syren er kjent som hypojoditter.
Disse saltene er mer stabile enn syre og dannes på samme måte som deres klor- og brom-kolleger, ved å reagere molekylært jod med alkali- eller jordalkalimetallhydroksider..
Hypojodsyre produseres ved å reagere molekylært jod med kvikksølv (II) oksid (Egon Wiberg, 2001) i henhold til reaksjonen:
2Ito + 3HgO + HtoO → 2HIO + HgIto ● 2HgO
Spor av forbindelsen oppnås også ved å reagere molekylært jod med kaliumhydroksid for å danne, innledningsvis kaliumjodid og kaliumhypojoditt i henhold til reaksjonen:
Jegto + 2KOH → KI + KIO
Imidlertid, hypojodsyre, som er en så svak syre, gjør hydrolysering av kaliumhypojoditt mulig med mindre det er overflødig kaliumhydroksid (Holmyard, 1922).
KIO + HtoO → HIO + KOH
Det kan også oppnås, i likhet med klor- og brom-kolleger, ved å reagere molekylært jod med vann. Men gitt sin lave likevektskonstant, som er i størrelsesorden 10-1. 3, mengdene som er oppnådd er veldig små (R.G. Compton, 1972).
Artikkelindeks
- 1 Fysiske og kjemiske egenskaper
- 2 Reaktivitet og farer
- 3 bruksområder
- 4 Referanser
Fysiske og kjemiske egenskaper
Hypojodsyre eksisterer bare som en vandig løsning som er gulaktig i fargen. Forbindelsen i fast tilstand har ikke blitt isolert, så de fleste av egenskapene oppnås teoretisk gjennom beregningsberegninger (National Center for Biotechnology Information, 2017).
Hypojodsyre har en molekylvekt på 143,911 g / mol, et smeltepunkt på 219,81 ° C, et kokepunkt på 544,27 ° C og et damptrykk på 6,73 x 10-14 milimeter kvikksølv.
Molekylet er veldig løselig i vann og kan oppløses mellom 5,35 x 105 og 8,54 x 105 gram forbindelse per liter av dette løsningsmidlet (Royal Society of Chemistry, 2015).
HOI er en sterk oksidant og kan danne eksplosive blandinger. Det er også et reduksjonsmiddel og kan oksyderes til jod-, jod- og periodiske former av syren. I vandige oppløsninger, som en svak syre, dissosierer den seg delvis i hypojodittionen (OI-) og H+.
HOI reagerer med baser for å danne salter som kalles hypoioditter. For eksempel dannes natriumhypojoditt (NaOI) ved å reagere hypojodsyre med natriumhydroksid..
HOI + NaOH → NaOI + HtoELLER
Hypojodsyre reagerer også lett med en rekke organiske molekyler og biomolekyler..
Reaktivitet og farer
Hypojodsyre er en ustabil forbindelse som brytes ned til elementært jod. Jod er en giftig forbindelse som må håndteres med forsiktighet.
Hypojodsyre er farlig ved hudkontakt (irriterende), i kontakt med øynene (irriterende) og i tilfeller av svelging og innånding.
Ved kontakt med øynene, sjekk om du bruker kontaktlinser og fjern dem umiddelbart. Øyene skal skylles med rennende vann i minst 15 minutter, slik at øyelokkene holdes åpne. Kaldt vann kan brukes. Øyesalve skal ikke brukes.
Hvis kjemikaliet kommer i kontakt med klær, må du fjerne det så raskt som mulig, og beskytte dine egne hender og kropp. Sett offeret under en sikkerhetsdusj.
Hvis kjemikaliet akkumuleres på utsatt hud fra offeret, for eksempel hender, vaskes den forurensede huden forsiktig og forsiktig med rennende vann og ikke-slipende såpe. Kaldt vann kan brukes. Hvis irritasjon vedvarer, kontakt lege. Vask de forurensede klærne før du bruker dem igjen.
Hvis hudkontakten er alvorlig, bør den vaskes med et desinfiserende såpe og dekke forurenset hud med en antibakteriell krem..
Ved innånding skal offeret få hvile i et godt ventilert område. Hvis innånding er alvorlig, skal offeret evakueres til et trygt område så snart som mulig. Løsne stramme klær som en skjortekrage, belte eller slips.
Hvis offeret har vanskelig for å puste, bør oksygen administreres. Hvis offeret ikke puster, utføres gjenoppliving fra munn til munn. Husk alltid at det kan være farlig for personen som yter hjelp til å gi gjenoppliving fra munn til munn når det inhalerte materialet er giftig, smittsom eller etsende..
Ved svelging, fremkall ikke brekninger. Løsne tette klær som skjortekrage, belter eller slips. Hvis offeret ikke puster, må du utføre gjenoppliving fra munn til munn.
I alle tilfeller, søk øyeblikkelig legehjelp..
applikasjoner
Hypojodsyre brukes som et kraftig oksidasjonsmiddel og som et reduksjonsmiddel i laboratoriereaksjoner. Den brukes til å produsere kjemiske forbindelser kjent som hypojoditter..
Spektrofotometriske metoder brukes også til å måle dannelsen av hypojodsyre for å overvåke reaksjoner der jod er involvert (T. L. Allen, 1955).
Halider er innlemmet i aerosoler, hvor de begynner den katalytiske destruksjonen av ozon (O3) over havene og påvirke den globale troposfæren. To spennende miljøproblemer som gjennomgår pågående forskning er: å forstå hvordan molekylære halogener i den reaktive gassfasen produseres direkte fra uorganiske halogenider utsatt for O3 og begrense miljøfaktorene som styrer denne grensesnittprosessen.
I arbeidet med (Elizabeth A. Pillar, 2013) ble omdannelsen av jodid til hypojodsyre ved virkningen av ozon målt gjennom massespektroskopimålinger for å bestemme en modell for ozonnedbryting i atmosfæren..
Referanser
- Egon Wiberg, N. W. (2001). Uorganisk kjemi. London: Akademisk presse.
- Elizabeth A. Pillar, M. I. (2013). Omdannelse av jod til hypojodsyre og jod i vandige mikrodropper utsatt for ozon. Sci. Technol., 47 (19), 10971-10979.
- EMBL-EBI. (2008, 5. januar). hypojodsyre. Hentet fra ChEBI: ebi.ac.uk.
- Holmyard, E. (1922). Uorganisk kjemi. London: Edwar Arnol & co.
- Nasjonalt senter for bioteknologisk informasjon ... (2017, 22. april). PubChem Compound Database; CID = 123340. Hentet fra PubChem.
- G. Compton, C. B. (1972). Reaksjoner av ikke-metalliske uorganiske forbindelser. Ansterdam: Elsevier Publishing Company.
- Royal Society of Chemistry. (2015). Jodol. Hentet fra chemspider.com.
- L. Allen, R. M. (1955). Dannelsen av hyposjodsyre og hydrert jodkation ved hydrolyse av jod. J. Am. Chem. Soc., 77 (11) , 2957-2960.


Ingen har kommentert denne artikkelen ennå.