
Progressivt sublimeringskonsept, prosess og eksempler

De progressiv sublimering Det er en termodynamisk prosess der endoterm tilstandsendring skjer direkte fra et fast stoff til en gass, uten forutgående dannelse av væsken. Faststoffets oppførsel under normale forhold er å varme opp og smelte; det vil si å slå seg sammen. I mellomtiden begynner det faste stoffet å røyke direkte i sublimeringen, uten at det tidligere opptrer dråper som indikerer smelting..
Det som er beskrevet i avsnittet ovenfor er representert i bildet ovenfor. Anta at en solid oransje blanding (til venstre) begynner å varme opp. Blandingen består av to komponenter eller faste stoffer: den ene gule og den andre rød, hvis kombinasjon resulterer i den oransje fargen..
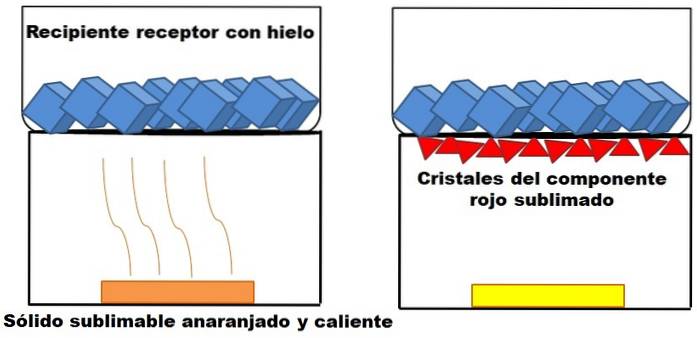
Det røde faste stoffet sublimerer, siden det ikke dannes en væske fra det, men ender opp med (røde trekanter) ved bunnen av den øvre beholderen; den som inneholder isbiter, og som derfor har en kald overflate. I mellomtiden forblir det gule faste stoffet uendret av varme (gult rektangel).
De røde trekanter eller krystaller er avsatt takket være den kalde overflaten på mottaksbeholderen (til høyre), som absorberer temperaturen; Og selv om den ikke vises, bør størrelsen på isbitene dine reduseres på grunn av opptak av varme. Det gule faste stoffet er ikke sublimerbart, og hvis du fortsetter å varme det før eller senere, smelter det.
Artikkelindeks
- 1 Progressivt sublimeringskonsept
- 1.1 Prosess
- 1.2 Fra solid struktur til gasslidelse
- 1.3 Fasediagram og trippelpunkt
- 1.4 Betingelser
- 2 Eksempler
- 2.1 Rensing av faste stoffer
- 2.2 Krystallsyntese
- 3 Referanser
Progressivt sublimeringskonsept
Prosess
Det er allerede blitt sagt at sublimering er en endotermisk tilstandsendring, for at den må forekomme må det være varmeabsorpsjon. Hvis det faste stoffet absorberer varme, vil energien øke, så partiklene vil også vibrere ved høyere frekvenser..
Når disse vibrasjonene blir veldig sterke, ender de med å påvirke intermolekylære interaksjoner (ikke kovalente bindinger); og følgelig vil partiklene før eller siden ta større avstander fra hverandre til de klarer å strømme og bevege seg mer fritt gjennom områdene i rommet.
I noen faste stoffer er vibrasjonene så sterke at noen partikler "skyter" ut av strukturen i stedet for å samle seg i bevegelige klynger som definerer en dråpe. Disse partiklene slipper ut og danner den første "boblen", som heller vil danne de første dampene fra det sublimerte faste stoffet..
Vi snakker da ikke om et smeltepunkt, men om et sublimeringspunkt. Selv om begge er avhengige av trykket som hersker på det faste stoffet, er sublimeringspunktet mer; derfor varierer temperaturen bemerkelsesverdig med trykkendringer (det samme gjør kokepunktet).
Fra solid struktur til gasslidelse
I sublimering sies det også at det er en økning i entropien til systemet. Partiklenes energitilstander går fra å være begrenset av deres faste posisjoner i den faste strukturen, til å homogenisere i deres lunefulle og kaotiske retninger i gassform, mer uniform, hvor de til slutt får en gjennomsnittlig kinetisk energi..
Fasediagram og trippelpunkt
Sublimeringspunktet avhenger av trykket; fordi ellers ville de faste partiklene absorbere varme for ikke å skyte ut i rommet utenfor det faste stoffet, men for å danne dråper. Det ville ikke sublimere, men det ville smelte eller smelte, som det er vanligst.
Jo større det ytre trykket er, desto mindre sannsynlig er sublimering, ettersom det faste stoffet blir tvunget til å smelte.
Men hvilke faste stoffer er sublimerbare og hvilke ikke? Svaret ligger i P vs T-fasediagrammene, som vist nedenfor:
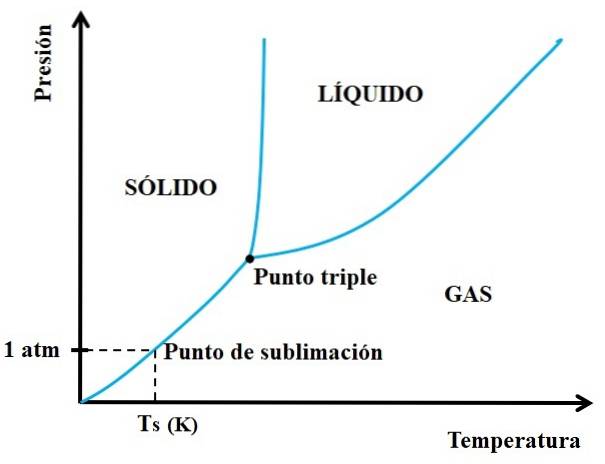
Vi må først se på trippelpunktet og gå gjennom den nedre delen: den som skiller de faste og gassformede tilstandene. Vær oppmerksom på at i området av det faste stoffet, må det være et fall i trykk for at sublimering skal forekomme (ikke nødvendigvis ved 1 atm, vårt atmosfæriske trykk). Ved 1 atm vil det hypotetiske stoffet sublimere seg ved en temperatur Ts uttrykt i K.
Jo lengre og vannrett snittet eller kurven under trippelpunktet er, jo større er kapasiteten til det faste stoffet til å sublimere seg ved forskjellige temperaturer; men hvis det er godt under 1 atm, vil det være behov for høye støvsugere for å oppnå sublimering, på en slik måte at trykket senkes (for eksempel 0,0001 atm).
Vilkår
Hvis trippelpunktet er tusenvis av ganger lavere enn atmosfæretrykket, vil det faste stoffet aldri sublimere seg selv når det påføres ultravakuum (for ikke å nevne dets følsomhet for nedbrytning ved hjelp av varme).
Hvis dette ikke er tilfelle, utføres sublimeringene ved moderat oppvarming, og utsetter det faste stoffet for et vakuum slik at partiklene slipper lettere ut, uten at de trenger å absorbere så mye varme..
Sublimering blir veldig viktig når det gjelder spesielt faste stoffer med høyt damptrykk; det vil si trykket inni, en refleksjon av effektiviteten av deres interaksjoner. Jo høyere damptrykk, jo mer duftende er det og jo mer sublimerbart er det..
Eksempler
Rensing av faste stoffer
Bildet av det oransje faste stoffet og dets sublimerbare rødlige komponent er et eksempel på hva sublimering representerer når det gjelder rensing av faste stoffer. Røde trekanter kan sublimeres etter behov til høy renhet er garantert.
Denne teknikken brukes mest med duftende faste stoffer. For eksempel: kamfer, koffein, benzoin og mentol.
Blant andre faste stoffer som kan være sublimering har vi: jod, is (i høye høyder), teobromin (fra sjokolade), sakkarin, morfin og andre medikamenter, nitrogenholdige baser og antracen.
Krystallsyntese
Når vi går tilbake til de røde trekanter, tilbyr sublimering et alternativ til konvensjonell krystallisering; Krystaller vil ikke lenger syntetiseres fra en løsning, men gjennom en mest mulig kontrollert avsetning av damp på en kald overflate, hvor det praktisk kan være krystallinske frø for å favorisere en spesifikk morfologi.
Si, hvis du har røde firkanter, vil krystallveksten beholde denne geometrien, og de bør ikke bli trekantede. De røde rutene vil gradvis vokse når sublimeringen finner sted. Imidlertid er det et operasjonelt og molekylært komplekst kompleks, hvor mange variabler er involvert..
Eksempler på krystaller syntetisert via sublimering er: silisiumkarbid (SiC), grafitt, arsen, selen, fosfor, aluminiumnitrid (AlN), kadmiumsulfid (CdS), sinkselenid (ZnSe), kvikksølvjodid (HgI).to), grafen, blant andre.
Merk at dette egentlig er to sammenflettede fenomener: progressiv sublimering og avsetning (eller invers sublimering); dampen vandrer fra det faste til kaldere områder eller overflater og til slutt legger seg i form av krystaller.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Wikipedia. (2019). Sublimering (faseovergang). Gjenopprettet fra: en.wikipedia.org
- Jones, Andrew Zimmerman. (27. januar 2019). Sublimering. Gjenopprettet fra: thoughtco.com
- Sheila Morrissey. (2019). Hva er sublimering i kjemi? - Definisjon, prosess og eksempler. Studere. Gjenopprettet fra: study.com
- Elsevier B.V. (2019). Sublimeringsmetode. ScienceDirect. Gjenopprettet fra: sciencedirect.com
Ingen har kommentert denne artikkelen ennå.