
Alifatiske hydrokarboneregenskaper, nomenklatur, reaksjoner, typer
De Alifatiske hydrokarboner er alle de som mangler aromatisitet, ikke i en luktesans, men med hensyn til kjemisk stabilitet. Å klassifisere hydrokarboner på denne måten er i dag for tvetydig og upresis, siden det ikke diskriminerer ulike typer hydrokarboner som ikke er aromatiske..
Dermed har vi alifatiske hydrokarboner og aromatiske hydrokarboner. Sistnevnte gjenkjennes av deres basisenhet: benzenringen. De andre kan derimot vedta hvilken som helst molekylær struktur: lineær, forgrenet, syklisk, umettet, polysyklisk; så lenge de ikke har konjugerte systemer som benzen.

Uttrykket 'alifatisk' ble født fra det greske ordet 'aleiphar', som betyr fett, også brukt til å referere til oljer. Derfor ble denne klassifiseringen tildelt hydrokarboner fra oljeholdige ekstrakter på 1800-tallet; mens aromatiske hydrokarboner ble ekstrahert fra treharpikser og duftende.
Da grunnlaget for organisk kjemi ble konsolidert, ble det imidlertid oppdaget at det var en kjemisk egenskap som differensierte hydrokarboner, enda viktigere enn deres naturlige kilder: aromatisitet (og ikke duft).
På denne måten opphørte alifatiske hydrokarboner å være bare de som er oppnådd fra fett, for å være alle de som mangler aromatisitet. Innenfor denne familien har vi alkaner, alkener og alkyner, uansett om de er lineære eller sykliske. Det er derfor 'alifatisk' blir ansett som upresis; selv om det er nyttig å ta opp noen generelle aspekter.
For eksempel, når du sier alifatiske 'ender' eller 'kjeder', refererer du til molekylære regioner der aromatiske ringer er fraværende. Av alle alifatiske hydrokarboner er den enkleste per definisjon metan, CH4; mens benzen er den enkleste av de aromatiske hydrokarboner.
Artikkelindeks
- 1 Egenskaper til alifatiske hydrokarboner
- 2 Nomenklatur
- 3 Reaksjoner
- 3.1 Forbrenning
- 3.2 Tillegg
- 3.3 Halogenering
- 3.4 Sprekker
- 4 typer
- 5 bruksområder
- 6 Eksempler
- 7 Referanser
Egenskaper av alifatiske hydrokarboner
Egenskapene til alifatiske hydrokarboner varierer i forskjellige grader, avhengig av hvilke som blir vurdert. Det er de med lave og høye molekylmasser, så vel som lineære, forgrenede, sykliske eller polysykliske, til og med de med forbløffende tredimensjonale strukturer; som med den kubanske, kubeformede.
Imidlertid er det noen generaliteter som kan nevnes. De fleste alifatiske hydrokarboner er hydrofobe og apolære gasser eller væsker, med noe mer apolare enn andre, siden selv de i hvis karbonkjeder inneholder halogen-, oksygen-, nitrogen- eller svovelatomer er inkludert..
På samme måte er de brennbare forbindelser, siden de er utsatt for oksidasjon i luften med en minimal varmekilde. Denne karakteristikken blir farligere hvis vi legger til den høye volatiliteten, på grunn av de svake dispersive interaksjonene som holder alifatiske molekyler sammen..
Vi ser dette for eksempel i butan, en gass som relativt lett kan flytes i likhet med propan. Begge er svært flyktige og brannfarlige, noe som gjør dem til aktive komponenter i kokegass eller lightere..
Selvfølgelig har denne flyktigheten en tendens til å avta når molekylmassen øker og hydrokarbonet produserer stadig viskøse og oljete væsker..
Nomenklatur
Nomenklaturen for hydrokarboner adskiller seg enda mer enn deres egenskaper. Hvis det er alkaner, alkener eller alkyner, følges de samme reglene som er fastsatt av IUPAC: velg den lengste kjeden, tildel de laveste indikatorene til den mest substituerte enden eller til de mest reaktive heteroatomer eller grupper.
På denne måten er det kjent på hvilket karbon hver substituent er funnet, eller til og med umettelsene (dobbelt- eller trippelbindinger). Når det gjelder sykliske hydrokarboner, går navnet foran substituentene oppført i alfabetisk rekkefølge, etterfulgt av ordet "syklus", og teller karbonantallene som utgjør det..
Tenk for eksempel på følgende to cykloheksaner:
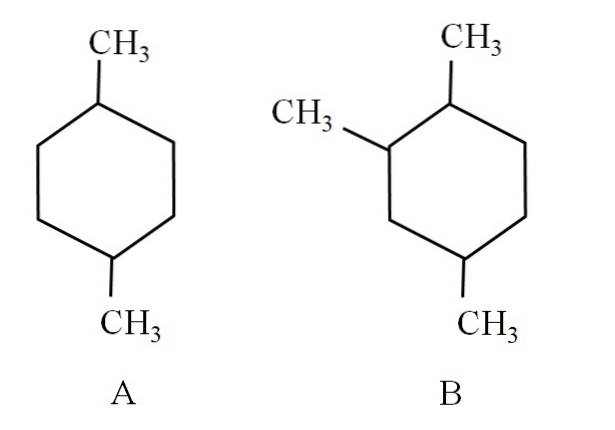
Sykloheksan A kalles 1,4-dimetylcykloheksan. Hvis ringen var fem karbonatomer, ville den være 1,4-dimetylsyklopentan. I mellomtiden kalles cykloheksan B 1,2,4-trimetylcykloheksan, og ikke 1,4,6-cykloheksan, siden det søker å bruke de laveste indikatorene..
Nå kan nomenklaturen bli veldig komplisert for hydrokarboner med bisarre strukturer. For dem er det mer spesifikke regler, som må forklares separat og nøye; som med diener, terpener, polyener og polysykliske forbindelser.
Reaksjoner
Forbrenning
Heldigvis er reaksjonene mindre varierte for disse hydrokarboner. En av dem har allerede blitt nevnt: de brenner lett og produserer karbondioksid og vann, så vel som andre oksider eller gasser, avhengig av tilstedeværelsen av heteroatomer (Cl, N, P, O, etc.). COto og HtoEller er de de viktigste forbrenningsproduktene.
Addisjon
Hvis de presenterer umettninger, kan de gjennomgå tilleggsreaksjoner; det vil si at de inkorporerer små molekyler i ryggraden som substituenter etter en spesifikk mekanisme. Blant disse molekylene har vi vann, hydrogen og halogener (Fto, Clto, Brto og jegto).
Halogenering
På den annen side, alifatiske hydrokarboner under forekomsten av ultrafiolett stråling (hv) og varme kan bryte C-H-obligasjoner for å bytte dem mot C-X-obligasjoner (C-F, C-Cl, etc.). Dette er halogeneringsreaksjonen, som observeres i svært kortkjedede alkaner, slik som metan eller pentan..
Sprekker
En annen reaksjon som alifatiske hydrokarboner, spesielt langkjedede alkaner, kan gjennomgå, er termisk krakking. Den består av tilførsel av intens varme, slik at den termiske energien bryter C-C-bindingene, og dermed blir små molekyler dannet, mer verdsatt i drivstoffmarkedet, fra store molekyler.
De fire reaksjonene ovenfor er de viktigste som et alifatisk hydrokarbon kan gjennomgå, forbrenning er det viktigste av alt, siden det ikke diskriminerer noen forbindelse; alle vil brenne i nærvær av oksygen, men ikke alle vil legge til molekyler eller brytes ned i små molekyler.
Typer
Alifatiske hydrokarboner grupperer et uendelig antall forbindelser, som igjen klassifiseres på en mer spesifikk måte, noe som indikerer graden av umettetheten, samt hvilken type struktur de har..
I henhold til hvor umettede de er, har vi alkaner (mettede), alkener og alkyner (umettede).
Alkaner kjennetegnes ved å ha enkle CC-bindinger, mens vi i alkener og alkyner observerer henholdsvis C = C og C≡C-bindinger. En veldig generell måte å visualisere dem på er å tenke på karbonskjelettene til alkaner som sikksakk og bøyde kjeder, som er "firkanter" for alkener, og "rette linjer" for alkyner..
Dette skyldes det faktum at de doble og tredobbelte bindingene gir energi og sterisk begrensning i rotasjonene, "herder" strukturene deres..
Alkaner, alkener og alkyner kan være forgrenede, sykliske eller polysykliske. Det er derfor cycloalkanes, cycloalkenes, cycloalkines, og forbindelser som decalin (bicyclo struktur), adamantane (ligner på en baseball cap), heptalen, gonan, blant andre, også betraktet som alifatiske hydrokarboner..
Andre typer hydrokarboner kommer fra alkener, som diener (med to dobbeltbindinger), polyener (med mange alternerende dobbeltbindinger) og terpener (forbindelser avledet fra isopren, en dien).
applikasjoner
Igjen kan bruken av disse hydrokarboner variere avhengig av hvilken man vurderer. I egenskapene og reaksjonene ble det imidlertid gjort klart at de alle brenner, ikke bare for å frigjøre gassformige molekyler, men også lys og varme. Dermed er de energireservoarer, nyttige for å tjene som drivstoff eller varmekilder..
Derfor brukes de som en del av sammensetningen av bensin, til naturgass, i Bunsen-brennere, og generelt for å kunne starte branner..
Et av de mest bemerkelsesverdige eksemplene er acetylen, HC2CH, hvis forbrenning gjør det mulig for metallionene i en prøve å bli eksitert i atomabsorpsjonsspektrometri utført i analytiske tester. Den resulterende brannen kan også brukes til sveising.
Flytende alifatiske hydrokarboner, som parafiniske stoffer, brukes ofte som ekstraksjonsløsningsmidler for fett. I tillegg kan løsemiddelvirkningen brukes til å fjerne flekker, emaljer, maling eller bare for å fremstille løsninger av en bestemt organisk forbindelse.
De med høyest molekylvekt, enten de er viskøse eller faste, brukes til produksjon av harpikser, polymerer eller medisiner.
Når det gjelder begrepet "alifatisk", brukes det ofte til å referere til de regionene, i et makromolekyl, som mangler aromatisitet. For eksempel blir asfaltener overfladisk beskrevet som en aromatisk kjerne med alifatiske kjeder.
Eksempler
Først ble det sagt at metan er den enkleste av de alifatiske hydrokarboner. Det etterfølges av propan, CH3CHtoCH3, butan, CH3CHtoCHtoCH3, pentan, CH3CHtoCHtoCHtoCH3, oktan, nonan, dekan og så videre, med lengre og lengre alkaner.
Det samme gjelder etylen, CHto= CHto, propen, CH3CH = CHto, butene, CH3CHtoCH = CH3, og for resten av alkynene. Hvis det er to dobbeltbindinger, er de diener, og hvis det er mer enn to, polyener. På samme måte kan det være dobbelt- og trippelbindinger i samme skjelett, noe som øker strukturell kompleksitet..
Blant cykloalkanene kan vi nevne cyklopropan, cyklobutan, cyklopentan, cykloheksan, cykloheptan, cyklooktan, samt cykloheksen og cykloheksin. Forgrenede derivater oppnås i sin tur fra alle disse hydrokarboner, de tilgjengelige eksemplene multipliserer enda mer (for eksempel 1,4-dimetylcykloheksan).
Av de mest representative terpenene har vi limonen, mentol, pinene, vitamin A, squalen etc. Polyetylen er en polymer mettet med -CH-enheterto-CHto-, så det er også et eksempel på disse hydrokarboner. Andre eksempler er allerede sitert i de foregående avsnittene.
Referanser
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10. utgave.). Wiley pluss.
- Helmenstine, Anne Marie, Ph.D. (22. august 2019). Definisjon av alifatisk hydrokarbon. Gjenopprettet fra: thoughtco.com
- Wikipedia. (2019). Alifatisk forbindelse. Gjenopprettet fra: en.wikipedia.org
- Kjemi LibreTexts. (20. august 2019). Alifatiske hydrokarboner. Gjenopprettet fra: chem.libretexts.org
- Elizabeth Wyman. (2019). Alifatiske hydrokarboner: definisjon og egenskaper. Studere. Gjenopprettet fra: study.com



Ingen har kommentert denne artikkelen ennå.