
Strukturformel (med eksempler)
De strukturformel det er en grafisk fremstilling av bindingen til et molekyl, som kaster lys over strukturen en gang bestemt av spektroskopiske metoder. Det er den mest spesifikke måten når det refereres til en spesifikk forbindelse, og ikke til flere isomerer som tilsvarer den samme molekylformelen.
For eksempel butan, C4H10, har to isomerer: n-butan (lineær) og 2-metyl-propan (forgrenet). Molekylformelen skiller ikke mellom noen av de to; mens hvis vi tyr til strukturformler, vil det sees nøyaktig at den ene er lineær og den andre forgrenet.
Ved å bruke strukturformler blir det lettere å forstå endringene som et molekyl gjennomgår under en kjemisk reaksjon; hvilke av koblingene som er ødelagte, hvordan strukturen endres i prosessen og på slutten av den. Å lære å lese disse formlene er det samme som å overflatisk forutsi molekylenes egenskaper.
Strukturformler er 2D-representasjoner, selv om de kan indikere noen tredimensjonale og geometriske aspekter. Jo mer strukturen til en forbindelse undersøkes, jo mer raffinert og trofast blir strukturformelen. Ellers utelater det essensielle aspekter for å forstå molekylets natur.
Artikkelindeks
- 1 Eksempler på strukturformel
- 1.1 Glukose
- 1.2 Metan
- 1.3 Metanol
- 1.4 Etanol
- 1.5 Fruktose
- 1.6 Vann
- 1.7 Aspirin
- 1.8 Benzen
- 2 Referanser
Eksempler på strukturelle formler
Hver forbindelse har sin respektive strukturformel, som kan variere avhengig av typen projeksjon eller perspektiv som brukes. For eksempel er kondenserte og skjelettformler, Lewis-strukturer og stereokjemiske projeksjoner alle strukturformler, dedikert til å tegne så mye informasjon som mulig angående molekylær struktur..
Det er så mange at bare noen få enkle eksempler vil bli tatt opp..
Glukose

Fire representasjoner av glukosemolekylet er vist i det øvre bildet. Hver er en gyldig strukturformel; men 2 (Haworth-projeksjon) og 3 (stolprojeksjon) er vanligvis de mest brukte i akademiske tekster og i publikasjoner.
4 har fordelen at den direkte indikerer hvilke OH-grupper som er over (tykke kiler) eller under (prikkede kiler) den sekskantede ringen; det vil si det letter forståelsen av stereokjemi. I kontrast viser 1 (Tollens-Fisher-projeksjon) den lineære karakteren av glukose før den konverteres til sin sykliske form.
Metan
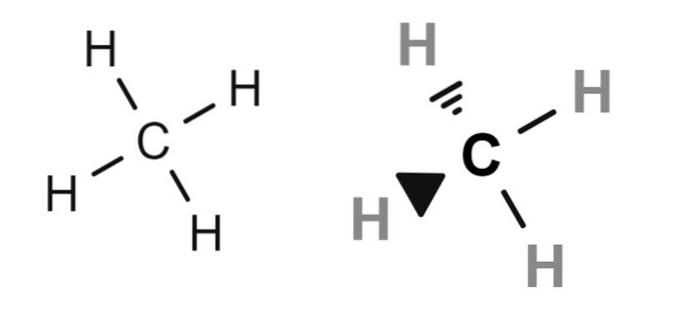
Ovenfor er det to strukturformler av metan, hvis kondenserte molekylformel er CH4. For de som mangler kjemi, kan de tolke formelen CH4 som om det var et molekyl med et hydrogenatom i sentrum.
Men i virkeligheten (og nødvendigvis) gjør strukturformlene det klart at karbon er det sentrale atomet. Derfor har vi fire C-H obligasjoner. Vær også oppmerksom på at formelen til venstre skaper et feilaktig inntrykk av at molekylet er flatt, når det i virkeligheten er tetraeder (formel til høyre).
Derfor er bindingene i strukturformelen til høyre representert av kiler, som indikerer de relative romlige posisjonene til hvert hydrogenatom (tetraederens hjørner).
Metanol

Strukturformelen til metanol er praktisk talt den samme som metan, med den forskjellen at den har en H substituert med en OH. Den kondenserte eller kjemiske formelen er CH3OH, og det molekylære CH4O. Det observeres at den også består av en tetraeder.
Etanol
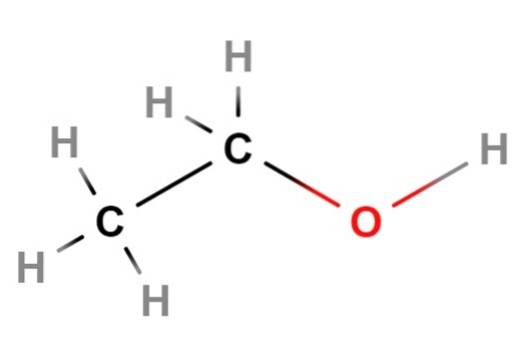
Nå går vi over til etanol, den neste alkoholen på listen. Dens kjemiske eller kondenserte formel er CH3CHtoOH, som i seg selv allerede viser sin lineære struktur. For å være sikker demonstrerer strukturformelen i bildet ovenfor effektivt at etanol er en lineær kjede eller skjelett..
Hvis du ser nøye etter, er omgivelsene til hvert karbonatom tetraeder.
Fruktose

Ovenfor har vi strukturformelen fruktose, nærmere bestemt Haworth-projeksjonen av furanusringen (femleddet). Legg merke til hvor mye strukturformelen avslører i motsetning til den molekylære, C6H12ELLER6, som sammenfaller med glukose, begge er imidlertid forskjellige sukkerarter.
Vann

Den kjemiske formelen for vann er HtoEller tilsvarende også med de kondenserte og molekylære formlene. Som med metan, kan de som ikke kjenner vannmolekylet (og ikke har noen forestilling om kjemiske bindinger) tro at strukturen er O-H-H; men strukturformelen i bildet ovenfor klargjør den sanne strukturen.
Selv om det ikke er verdsatt, trekker parene av frie elektroner av oksygen og hydrogenatomer en tetraeder rundt oksygenet; dette er den elektroniske geometrien til vann: tetraedral. I mellomtiden etablerer de to hydrogenatomene et plan som ligner på en boomerang; dette er molekylens geometri av vann: kantet.
Selv om strukturformelen for vann er den enkleste av eksemplene som er diskutert, skjuler det flere hemmeligheter og avvik enn det alene klarer å representere..
Aspirin
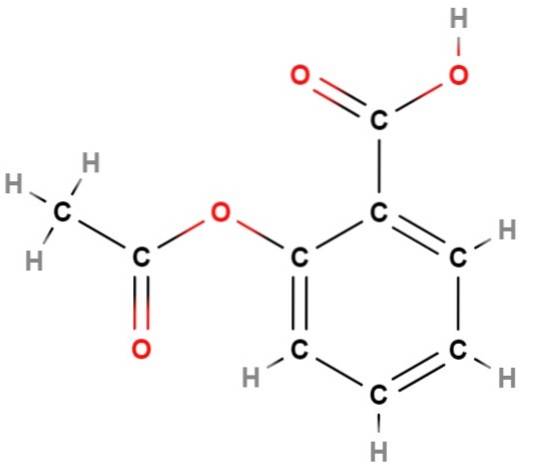
Vi har en av de første "feilene" i strukturformler: deres manglende evne til å representere den aromatiske karakteren til en struktur; som i dette tilfellet tilsvarer aromatisiteten til benzen (sekskantet) ring av aspirin (ovenfor).
Hvis du ser nøye på denne formelen, vil du konkludere med at det er et i hovedsak flatt molekyl; det vil si at nesten alle atomene "hviler" i samme plan, med unntak av metylgruppen, CH3, til venstre, der det tetraedrale miljøet av karbon igjen visualiseres.
Igjen gir strukturformelen mye mer informasjon enn dens enkle molekylformel, C9H8ELLER4; som tilsvarer mange strukturelle isomerer, helt forskjellige fra aspirin.
Benzen
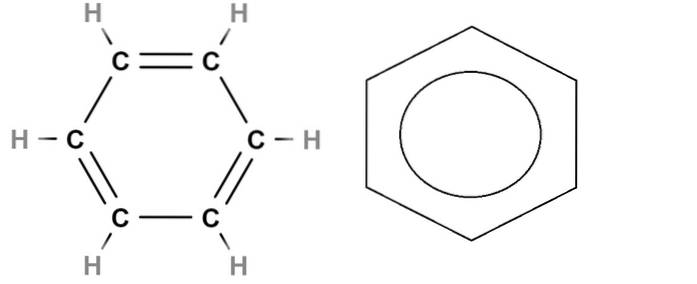
For å fullføre, har vi over strukturformelen til benzen. Molekylformelen er C6H6, noe som indikerer at den inneholder seks karbonatomer og seks hydrogenatomer. Men det sier ingenting om den virkelige strukturen til benzen.
C = C dobbeltbindinger er ikke statiske, siden et par elektroner, spesielt den som er plassert i orbitalene s av karbon, blir det avlokalisert i ringen. Følgelig har benzen flere resonansstrukturer, hver med sin egen strukturformel..
Denne delokaliseringen er en del av den aromatiske karakteren av benzen, ikke trofast representert i strukturformelen til venstre. Det nærmeste er å erstatte dobbeltbindinger med en sirkel (kalt en doughnut av noen) for å indikere aromatisiteten til ringen (til høyre på bildet).
Og hva med skjelettformelen? Dette ligner veldig på det strukturelle, og avviker bare ved at det ikke representerer hydrogenatomer; og derfor er det mer forenklet og mer behagelig å tegne graf. Benzenringen til høyre vil være skjelettformelen.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Wikipedia. (2020). Strukturell formel. Gjenopprettet fra: en.wikipedia.org
- Nissa Garcia. (2020). Strukturell formel: definisjon og eksempler. Studere. Gjenopprettet fra: study.com
- Clark Jim. (2012). Tegning av organiske molekyler. Gjenopprettet fra: chemguide.co.uk
- William Reusch. (5. mai 2013). Formen av molekyler. Gjenopprettet fra: 2.chemistry.msu.edu

Ingen har kommentert denne artikkelen ennå.