
Pikrinsyrestruktur, syntese, egenskaper og bruksområder
De pikrinsyre er en sterkt nitrert organisk kjemisk forbindelse hvis IUPAC-navn er 2,4,6-trinitrofenol. Molekylformelen er C6Hto(IKKEto)3ÅH. Det er en veldig sur fenol, og kan finnes som natrium, ammonium eller kaliumpikrat; det vil si i sin ioniske form C6Hto(IKKEto)3På en.
Det er et fast stoff med en sterk bitter smak, og derfra får det navnet sitt fra det greske ordet 'prikos', som betyr bitter. Det finnes som våte gule krystaller. Tørking eller dehydrering er farlig, siden det øker de ustabile egenskapene som gjør det eksplosivt.
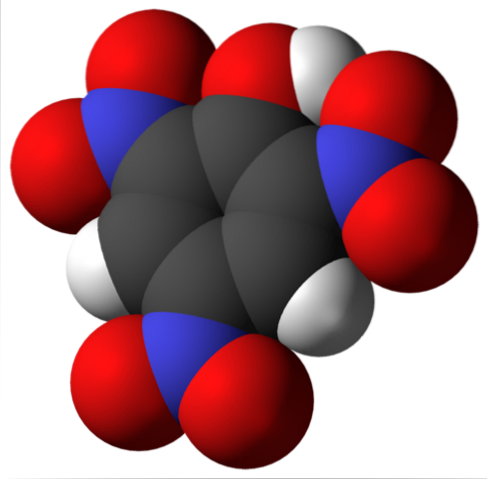
Pikrinsyremolekylet er vist ovenfor. På bildet er det vanskelig å gjenkjenne bindingene og atomene fordi dette tilsvarer representasjonen av overflaten av Van der Waals. Neste avsnitt tar for seg den molekylære strukturen mer detaljert..
Noen mellomforbindelser, forskjellige pikratsalter og komplekser av pikrinsyre syntetiseres fra pikrinsyre..
Pikrinsyre brukes som en base for syntesen av permanente gule fargestoffer. Noen patologer og forskere bruker det til fiksering eller farging av vevssnitt og andre immunhistokjemiske prosesser..
Det er veldig nyttig ved fremstilling av farmasøytiske produkter. I tillegg brukes den til produksjon av fyrstikker og eksplosiver. Det brukes også til å etse metaller, lage farget glass og ved kolorimetrisk bestemmelse av biologiske parametere som kreatinin..
På den annen side er pikrinsyre irriterende når den kommer i kontakt med huden, luftveiene, øye- og fordøyelsesslimhinnen. I tillegg til å skade huden, kan det alvorlig påvirke nyrer, blod og lever, blant andre organer..
Artikkelindeks
- 1 Struktur
- 1.1 Syrfenol
- 1.2 Krystallstruktur
- 2 Syntese
- 2.1 Direkte fenolnitrering
- 3 Fysiske og kjemiske egenskaper
- 3.1 Molekylvekt
- 3.2 Fysisk utseende
- 3.3 Lukt
- 3.4 Smak
- 3.5 Smeltepunkt
- 3.6 Kokepunkt
- 3.7 Tetthet
- 3.8 Løselighet
- 3.9 Korrosivitet
- 3,10 pKa
- 3.11 Ustabilitet
- 4 bruksområder
- 4.1 Forskning
- 4.2 Organisk kjemi
- 4.3 I industrien
- 4.4 Militære applikasjoner
- 5 Toksisitet
- 6 Referanser
Struktur

Det øvre bildet viser alle bindinger og selve strukturen til pikrinsyremolekylet i større detalj. Den består av en fenol med tre nitrosubstituenter.
Det kan sees at i gruppene NOto nitrogenatomet har en positiv partiell ladning, og krever derfor elektrontettheten i omgivelsene. Men den aromatiske ringen tiltrekker seg også elektroner mot seg selv, og før de tre NOto ender opp med å gi opp en del av sin egen elektroniske tetthet.
Som en konsekvens av dette, har oksygenet til OH-gruppen en tendens til å dele et av sine gratis elektroniske par for å forsyne den elektroniske mangelen som ringen lider av; og ved å gjøre dette dannes C = O-bindingen+-H. Denne delvis positive ladningen på oksygen svekker O-H-bindingen og øker surheten; det vil si at den frigjøres som et hydrogenion, H+.
Syre fenol
Det er av denne grunn at denne forbindelsen er en usedvanlig sterk (og reaktiv) syre, enda mer enn eddiksyre i seg selv. Imidlertid er forbindelsen faktisk en fenol hvis surhet overgår den for de andre fenolene; skyldes, som nettopp nevnt, NO-substituenteneto.
Derfor, siden det er en fenol, har OH-gruppen prioritet og dirigerer opptellingen i strukturen. De tre NEIto de er lokalisert ved karbonene 2, 4 og 6 i den aromatiske ringen med hensyn til OH. Det er her IUPAC-nomenklaturen for denne forbindelsen er avledet: 2,4,6-Trinitrophenol (TNP).
Hvis gruppene ikke var der, NEIto, eller hvis det var et mindre antall av dem i ringen, ville O-H-bindingen svekkes mindre, og derfor ville forbindelsen ha mindre surhet.
Krystallstruktur
Pikrinsyremolekyler er ordnet på en slik måte at de favoriserer deres intermolekylære interaksjoner; enten for dannelse av hydrogenbindinger mellom OH- og NO-grupperto, dipol-dipolkrefter, eller elektrostatiske frastøtinger mellom elektronmangelområder.
Det kan forventes at gruppene IKKE vil gjøre detto de frastøt hverandre og ville orientere seg i retning av nærliggende aromatiske ringer. Også ringene ville ikke være i stand til å stille opp hverandre på grunn av økte elektrostatiske frastøtinger..
Produktet av alle disse interaksjonene, klarer pikrinsyre å danne et tredimensjonalt nettverk som definerer en krystall; hvis enhetscelle tilsvarer et krystallinsk system av ortorhombisk type.
Syntese
Opprinnelig ble det syntetisert fra naturlige forbindelser som dyrehornderivater, naturlige harpikser, blant andre. Fra 1841 har fenol blitt brukt som en forløper for pikrinsyre, ved å følge forskjellige veier eller gjennom forskjellige kjemiske prosedyrer.
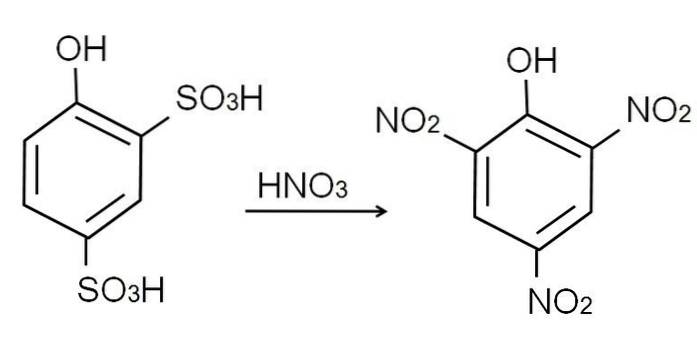
Som allerede nevnt er det en av de sureste fenolene. For å syntetisere den, gjennomgår fenolen først en sulfoneringsprosess, etterfulgt av en nitreringsprosess..
Sulfoneringen av vannfri fenol utføres ved å behandle fenolen med røykende svovelsyre, og produsere elektrofile aromatiske substitusjoner av H med sulfonatgrupper, SO3H, i -orto og -para posisjon med hensyn til OH-gruppen.
Dette produktet, 2,4-fenoldisulfonsyre, gjennomgår nitreringsprosessen og behandler det med konsentrert salpetersyre. Ved å gjøre dette, de to gruppene SO3H erstattes av nitrogrupper, NOto, og en tredje går inn i den andre nitroposisjonen. Følgende kjemiske ligning illustrerer dette:
Direkte fenolnitrering
Fenolnitreringsprosessen kan ikke utføres direkte, da det genereres tjære med høy molekylvekt. Denne syntesemetoden trenger en veldig nøye kontroll av temperaturen siden den er veldig eksoterm:
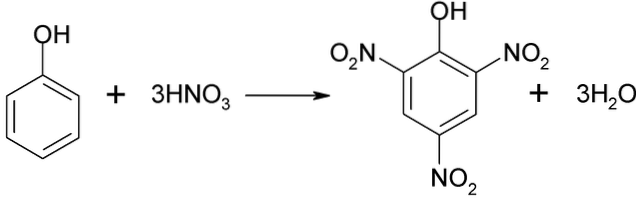
Pikrinsyre kan oppnås ved å utføre den direkte nitreringsprosessen av 2,4-dinitrofenol, med salpetersyre.
En annen måte å syntetisere er å behandle benzen med salpetersyre og kvikksølvnitrat..
Fysiske og kjemiske egenskaper
Molekylær vekt
229,104 g / mol.
Fysisk utseende
Gul masse eller suspensjon av våte krystaller.
Lukt
Det er luktfritt.
Smak
Det er veldig bittert.
Smeltepunkt
122,5 ° C.
Kokepunkt
300 ° C. Men når den smelter, eksploderer den.
Tetthet
1,77 g / ml.
Løselighet
Det er en moderat vannløselig forbindelse. Dette er fordi OH- og NO-gruppeneto de kan samhandle med vannmolekyler gjennom hydrogenbindinger; selv om den aromatiske ringen er hydrofob, og derfor svekker dens løselighet.
Korrosivitet
Pikrinsyre er generelt etsende for metaller, unntatt tinn og aluminium.
pKa
0,38. Det er en sterk organisk syre.
Ustabilitet
Pikrinsyre er preget av ustabile egenskaper. Det utgjør en risiko for miljøet, det er ustabilt, eksplosivt og giftig.
Den bør oppbevares tett lukket for å unngå dehydrering, siden pikrinsyre er veldig eksplosiv hvis den får tørke. Det må utvises stor forsiktighet med vannfri form, fordi den er veldig følsom for friksjon, støt og varme..
Pikrinsyre skal oppbevares på kjølig, ventilert sted, borte fra oksiderbare materialer. Det er irriterende ved kontakt med hud og slimhinner, skal ikke inntas og er giftig for kroppen.
applikasjoner
Pikrinsyre har blitt mye brukt i forskning, kjemi, industri og militæret..
Etterforskning
Når det brukes som fikseringsmiddel for celler og vev, forbedrer det resultatene av farging av disse med syrefargestoffer. Det skjer med trikrome fargemetoder. Etter fiksering av vevet med formalin, anbefales en ny fiksering med pikrinsyre..
På denne måten garanteres en intens og veldig lys farging av stoffene. Du får ikke gode resultater med grunnleggende fargestoffer. Imidlertid bør det tas forholdsregler, da pikrinsyre kan hydrolysere DNA hvis det blir for lenge..
Organisk kjemi
-I organisk kjemi brukes det som alkaliske pikrater for å utføre identifikasjon og analyse av forskjellige stoffer.
-Det brukes i analytisk kjemi av metaller.
-I kliniske laboratorier brukes det til bestemmelse av serum- og kreatininnivåer i urinen..
-Det har også blitt brukt i noen av reagensene som brukes til analyse av glukosenivåer..
I bransjen
-På fotografisk industrinivå har pikrinsyre blitt brukt som sensibiliserende middel i fotografiske emulsjoner. Det har vært en del av produksjonen av produkter som plantevernmidler, sterke insektmidler, blant andre.
-Pikrinsyre brukes til å syntetisere andre kjemiske mellomprodukter som kloropikrin og pikraminsyre, for eksempel. Noen medisiner og fargestoffer for lærindustrien er laget av disse forbindelsene..
-Pikrinsyre ble brukt til behandling av forbrenninger, som et antiseptisk middel og andre forhold, før dets toksisitet ble tydelig.
-Viktig komponent på grunn av sin eksplosive natur ved produksjon av fyrstikker og batterier.
Militære applikasjoner
-På grunn av den høye eksplosiviteten til pikrinsyre, har den blitt brukt i ammunisjonsanlegg for militære våpen.
-Presset og smeltet pikrinsyre har blitt brukt i artilleriskall, granater, bomber og gruver.
-Pikrinsyreammoniumsalt har blitt brukt som et eksplosivt stoff, det er veldig kraftig, men mindre stabilt enn TNT. En tid ble det brukt som en komponent i rakettdrivstoff.
Toksisitet
Det er bevist at det er veldig giftig for menneskekroppen og generelt for alle levende vesener.
Det anbefales å unngå innånding og svelging på grunn av dets akutte oral giftighet. Det forårsaker også mutasjon i mikroorganismer. Det har giftige effekter på dyrelivet, pattedyr og miljøet generelt.
Referanser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10th utgave.). Wiley pluss.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Wikipedia. (2018). Pikrinsyre. Gjenopprettet fra: en.wikipedia.org
- Purdue University. (2004). Pikrinsyreeksplosjon. Gjenopprettet fra: chemed.chem.purdue.edu
- Krystallografi 365-prosjekt. (10. februar 2014). Mindre enn myk gul - strukturen til pikrinsyre. Gjenopprettet fra: crystallography365.wordpress.com
- PubChem. (2019). Picric Acid. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Baker, J. R. (1958). Picric Acid. Methuen, London, Storbritannia.



Ingen har kommentert denne artikkelen ennå.