
Kiselsyreegenskaper, reaksjoner og bruksområder

De kiselsyre det er en hydrert form av silisiumoksid. Det er det generelle navnet for familien av kjemiske forbindelser dannet av et silisium, og en viss mengde hydrogen og oksygenmolekyler..
Den generelle formelen for disse syrene er [SiOx(ÅH)4-2x]n, og den vanligste formen der den vanligvis finnes er i orthosilicic acid H4Ja4.
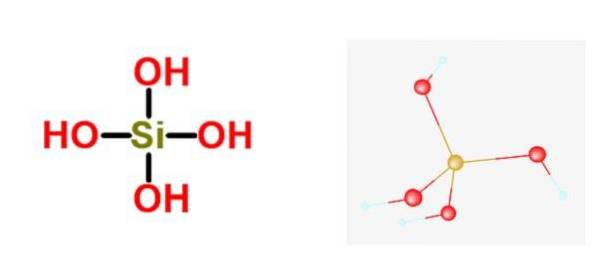
Kiselsyre er en del av familien Diverse silikater. Dette betyr at den største metalliske oksoanionen er silikatet, og at det ikke er festet noe ikke-metallisk atom til det. Det er noen isolerte tilfeller der de har ett ikke-metallisk atom, men aldri mer enn ett.
Fysiske egenskaper av kiselsyre
Kiselsyre eksisterer bare i to tilstander, amorfe og krystallinske. Den første oppnås ved en nedbørsprosess, og den andre presenteres som bergkrystall.
Kiselsyre i sin amorfe form (SiO3) er hvit, smakløs, uoppløselig i vann og danner ikke sammen med molekyler i seg selv noen sammenhengende plastmasse som forekommer med aluminium.
I sin krystallinske tilstand oppløses den ikke av noe oksysyre. Når en veldig fortynnet løsning av silisiumdioksydoppløsning behandles med svovelsyre, salpetersyre eller saltsyre, blir ikke kiselsyren utfelt. I stedet ser det ut til å være oppløst i vann som et hydrat.
Når en løsning av syren eller syren tilsettes en silikatoppløsning, utfelles hydratet i en gelatinøs form, at når det blir tørket og deretter oppvarmet med stor energi blir det et uoppløselig stoff.
Kjemiske reaksjoner
Kiselsyre er ekstremt svak og mister bare sitt første proton når det nærmer seg pH 10. Bare 3 kjente reaksjoner med denne syren forekommer under normale fysiologiske livsforhold..
- Reaksjon med seg selv når løseligheten overskrides for å danne amorf silisiumhydrat.
- Dens reaksjon med aluminiumhydroksyd for å danne aluminiumsilikathydroksid.
- Reaksjon med overskudd av molybdat for å danne heteropolysyrer slik som silikomolybdat.
Hvor finnes kiselsyre?
Etter oksygen er silisium det vanligste elementet i naturen, det er i form av krystaller. Når det er i vandig medium, blir det ikke-ioniserende, slik at silisiumsaltene i havet kan forsure silisiumet og skape kiselsyre..
Nettoinngangen til kiselsyre i verdenshavet er funnet ved 6,1 ± 2,0 teramol silisium per år (1 teramol = 1012 mol). Nesten 80% av dette bidraget kommer fra elver med en global gjennomsnittlig konsentrasjon på 150 mikromolar (konsentrasjon i vann).
I moderne marine sedimenter er nettoutbyttet av biogen silisium (transformasjon av oppløst silikat til partikkelformet skjelettmateriale) 7,1 ± 1,8 teramol per år.
Bruttoproduksjonen av biogen silika i overflatevann er 240 ± 40 teramol silisium per år, og konserveringsforholdet (akkumulering av opaler i sedimenter / bruttoproduksjon i overflatevann) er 3 prosent..
I floraen finnes den i planten Borago officinalis (Borraje), som i sammensetningen har opptil 2,2% kiselsyre.
Ortosilicic acid er den vanligste formen for kiselsyre, som finnes mange forskjellige steder. De største biotilgjengelige kildene til denne syren finnes i vann, enten i sjøvann eller i andre drikker som øl..
For å oppnå det i laboratoriet følger det samme prinsipp som i havet, det kan oppnås ved å forsure natriumsilikat i en vandig løsning..
Bruksområder i hverdagen
Tannkrem
Det er den slipende gelen som brukes i tannkrem, eller i den klare delen av ripet tannkrem, siden det i kombinasjon med kalsiumkarbonat hjelper deg med å fjerne plakk trygt med børsting.
Det er registrert som en sikker forbindelse med United States Food & Drug Administration og har ingen kjent toksisitet eller kreftfremkallende virkning.
Tørkemiddel
Når det tørkes i en ovn, mister det vann og blir et tørkemiddel (et stoff som trekker vann fra luften). Derfor kan du finne små pakker med silikagelkrystaller i beholdere hvis innhold kan bli skadet av fuktighet, for eksempel vitaminflasker, elektronikk, sko eller lærprodukter..
Andre bruksområder
Det finnes i gavebutikker som magiske steiner, kjemisk hage eller krystallhage. Den tørre formen blandes med salter av forskjellige metaller.
Når natrium kastes i vannet, erstattes det av metallet, og siden metallsilikatet ikke er løselig i vann, dannes et bunnfall av metallets karakteristiske farge. Metallsilikat utvides også som en gel og vokser som fargerike stalagmitter i vann..
Medisinske fordeler med ortosilicic acid (OSA)
Ortosilic syre er det beste biotilgjengelige silisiummediet for mennesker. Det kan brukes til å behandle forskjellige helsemessige forhold som Alzheimers sykdom, leddgikt, aterosklerose, hypertensjon, hjertesykdom, osteoporose, hjerneslag og hår.
Benhelse
I en studie fra 2008 på 136 kvinner med osteopeni, fikk de ortosilicic acid sammen med kalsium og vitamin D eller placebo hver dag i et år. Etter ett år forbedret deltakerne som fikk syren i beindannelsen.
Forskere sier at dette skyldes orthosilicic syre evne til å stimulere produksjonen av kollagen (et protein som finnes i bindevev) og å fremme utviklingen av beindannende celler..
Hår helse
En liten studie publisert i 2007 antyder at denne syren kan bidra til å forbedre hårets kvalitet og helse. I studien ble 48 kvinner med "fint hår" delt inn i to grupper og fikk placebo eller et ortosilisiumtilskudd i ni måneder..
Forskerne fant at ortosalisylsyre så ut til å øke hårstyrken og tykkelsen. Generelt er hårkvaliteten også forbedret med ortosalisylsyre-tilskudd.
Referanser
- Nasjonalt senter for bioteknologisk informasjon. PubChem Compound Database; CID = 14942. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov.
- Graham, T. (1863). Om egenskapene til kiselsyre og andre analoge kolloidale stoffer. Proceedings of the Royal Society of London, 13, 335-341. Gjenopprettet fra: jstor.org.
- Redaktørene av Encyclopedia Britannica (1998) Silicic Acid Chemical Compound. Leksikon Britannica. Gjenopprettet fra: britannica.com.
- Tomsofmaine.com. (2017). Hydrert silisiumdioksyd | Tom's of Maine. [online] Gjenopprettet fra: tomsofmaine.com.
- William Thomas Brande, Alfred Swaine Taylor. Kjemi. Blanchard og Lea. [online] Hentet 21. mars 2017 fra books.google.co.ve.id.
- Field, S. (2017). Hydrert silisiumdioksyd. [online] Hentet 22. mars 2017 fra: sci-toys.com.



Ingen har kommentert denne artikkelen ennå.