
Svovelsyre (H2SO4) egenskaper, struktur og bruksområder
De svovelsyre (HtoSW4) Det er en flytende, oljeaktig og fargeløs kjemisk forbindelse, løselig i vann med varmeutslipp og etsende for metaller og tekstiler. Forkarboniserer treverk og mest organiske stoffer ved kontakt med det, men det vil neppe forårsake brann.
Svovelsyre er kanskje den viktigste av alle tunge industrielle kjemikalier, og forbruk har blitt sitert mange ganger som en indikator på den generelle tilstanden til nasjonens økonomi..

Langvarig eksponering for lave konsentrasjoner eller kortvarig eksponering for høye konsentrasjoner kan føre til uheldige helseeffekter. Den desidert viktigste bruken av svovelsyre er i fosfatgjødselindustrien.
Andre viktige bruksområder er petroleumsraffinering, pigmentproduksjon, stålbeising, ekstraksjon av ikke-jernholdige metaller og fremstilling av eksplosiver, vaskemidler, plast, menneskeskapte fibre og legemidler..
Artikkelindeks
- 1 Vitriol, antecedenten til svovelsyre
- 2 Formel
- 3 Kjemisk struktur
- 3.1 I 2D
- 3.2 I 3D
- 4 funksjoner
- 4.1 Fysiske og kjemiske egenskaper
- 4.2 Reaksjoner med luft og vann
- 4.3 Brennbarhet
- 4.4 Reaktivitet
- 4.5 Toksisitet
- 5 bruksområder
- 5.1 Indirekte
- 5.2 Direkte
- 6 Utviklingen av svovelsyreindustrien
- 6.1 Vitriol-prosess
- 6.2 Blykamre
- 7 Nåværende produksjon: kontaktprosess
- 7.1 Dobbel kontaktprosess
- 8 Råvarer som brukes i produksjonen av svovelsyre
- 8.1 Pyritt
- 8.2 Svoveldioksid
- 8.3 Resirkulert
- 9 Kliniske effekter
- 10 Sikkerhet og risikoer
- 10.1 GHS fareklasser
- 10.2 Sikkerhetskoder
- 11 Referanser
Vitriol, antesedenten til svovelsyre
I middelalderens Europa ble svovelsyre kjent som vitriol, vitriol olje eller vitriol brennevin av alkymister. Det ble ansett som det viktigste kjemiske stoffet, og det ble forsøkt brukt som en filosof.
Sumererne hadde allerede en liste over forskjellige typer vitriol. I tillegg hevet Galen, den greske legen Dioscorides og Plinius den eldre sin medisinske bruk.

I hellenistiske alkymiske verk ble metallurgiske bruksområder av smertestillende stoffer allerede nevnt. Vitriol er en gruppe glasslegemineraler som svovelsyre kan oppnås fra.
Formel
-Formel: HtoSW4
-Cas-nummer: 7664-93-9
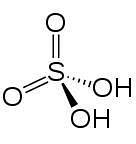
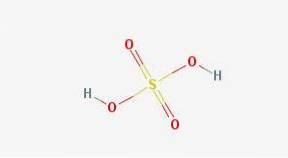
Kjemisk struktur
I 2D
I 3d
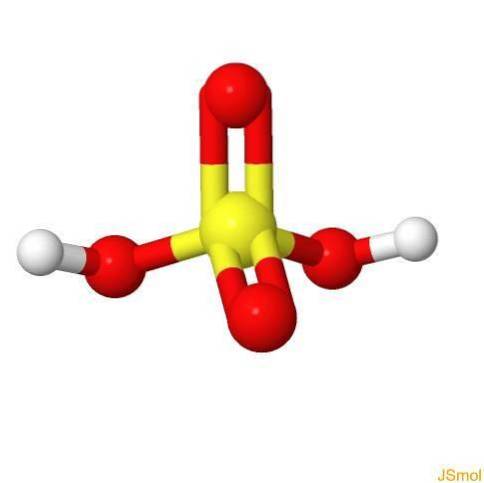
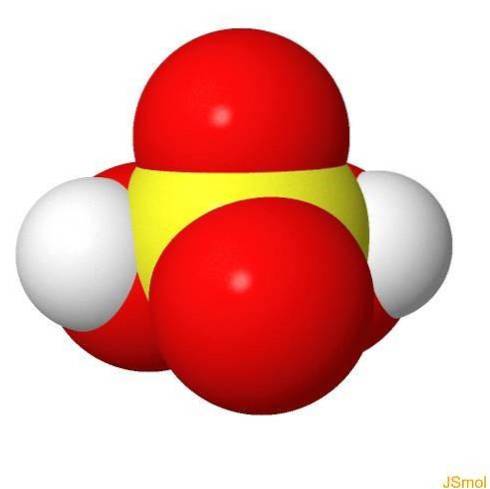
Kjennetegn
Fysiske og kjemiske egenskaper

Svovelsyre tilhører den reaktive gruppen av sterke oksiderende syrer.
Reaksjoner med luft og vann
- Reaksjonen med vann er ubetydelig med mindre surheten er over 80-90%, da er hydrolysevarmen ekstrem, det kan forårsake alvorlige forbrenninger.
Brennbarhet
- Sterke oksiderende syrer er generelt ikke brannfarlige. De kan akselerere forbrenningen av andre materialer ved å tilføre oksygen til forbrenningsstedet.
- Svovelsyre er imidlertid svært reaktiv og i stand til å antenne finfordelte brennbare materialer når de er i kontakt med dem..
- Ved oppvarming avgir den meget giftige røyk.
- Det er eksplosivt eller inkompatibelt med et stort utvalg av stoffer.
- Kan gjennomgå voldsomme kjemiske endringer ved høye temperaturer og trykk.
- Kan reagere voldsomt med vann.
Reaktivitet
- Svovelsyre er sterkt sur.
- Reagerer voldsomt med brompentafluorid.
- Eksplodere med paranitrotoluen ved 80 ° C.
- En eksplosjon oppstår når konsentrert svovelsyre blandes med krystallinsk kaliumpermanganat i en beholder som inneholder fuktighet. Det dannes manganheptoksid som eksploderer ved 70 ° C.
- Blandingen av akrylnitril med konsentrert svovelsyre må holdes godt nedkjølt, ellers oppstår en kraftig eksoterm reaksjon.
- Temperaturen og trykket øker når svovelsyre (96%) blandes i like store deler i en lukket beholder med et av følgende stoffer: acetonitril, akrolein, 2-aminoetanol, ammoniumhydroksid (28%), anilin, n-butyraldehyd, klorsulfon syre, etylendiamin, etylenimin, epiklorhydrin, etylencyanohydrin, saltsyre (36%), flussyre (48,7%), propylenoksid, natriumhydroksid, styrenmonomer.
- Svovelsyre (konsentrert) er ekstremt farlig i kontakt med karbider, bromater, klorater, primere, pikrater og pulveriserte metaller..
- Kan indusere voldsom polymerisering av allylklorid og reagerer eksoterm med natriumhypokloritt for å produsere klorgass.
- Blanding av klorsvovelsyre og 98% svovelsyre gir HCl.
Toksisitet
- Svovelsyre er etsende for alle vev i kroppen. Innånding av damp kan forårsake alvorlig lungeskade. Kontakt med øynene kan føre til totalt synstap. Kontakt med huden kan forårsake alvorlig nekrose.
- Å svelge svovelsyre, i en mengde mellom 1 ts og en halv unse av det konsentrerte kjemikaliet, kan være dødelig for en voksen. Selv noen få dråper kan være dødelige hvis syren kommer inn i luftrøret.
- Kronisk eksponering kan forårsake trakeobronchitt, stomatitt, konjunktivitt og gastritt. Gastrisk perforasjon og peritonitt kan forekomme og kan følges av sirkulasjonskollaps. Sirkulasjonssjokk er ofte den umiddelbare dødsårsaken.
- De med kroniske luftveis-, gastrointestinale eller nervesykdommer og øye- og hudsykdommer har økt risiko.
applikasjoner
- Svovelsyre er en av de mest brukte industrielle kjemikaliene i verden. Men det meste av bruken kan betraktes som indirekte, og deltar som et reagens i stedet for en ingrediens.
- Det meste av svovelsyren ender opp som syren som brukes til produksjon av andre forbindelser, eller som en slags sulfatrester.
- En rekke produkter inneholder svovel eller svovelsyre, men nesten alle er spesielle produkter med lite volum..
- Omtrent 19% av svovelsyren som ble produsert i 2014, ble konsumert i omtrent tjue kjemiske prosesser, og resten ble konsumert i et bredt utvalg av industrielle og tekniske applikasjoner.
- Veksten i etterspørselen etter svovelsyre over hele verden skyldes, i avtagende rekkefølge, produksjonen av: fosforsyre, titandioksid, flussyre, ammoniumsulfat og uranbehandling og metallurgiske anvendelser.
Indirekte
- Den største forbrukeren av svovelsyre er gjødselindustrien. Den representerte drøyt 58% av det totale verdensforbruket i 2014. Denne andelen forventes imidlertid å falle til ca 56% innen 2019, hovedsakelig som et resultat av høyere vekst i andre kjemiske og industrielle applikasjoner..
- Produksjonen av fosfatgjødselmaterialer, spesielt fosforsyre, er hovedmarkedet for svovelsyre. Det brukes også til fremstilling av gjødselmaterialer som trippel superfosfat og mono- og diammoniumfosfater. Mindre mengder brukes til produksjon av superfosfat og ammoniumsulfat.
- I andre industrielle anvendelser blir betydelige mengder svovelsyre brukt som et syre dehydratiseringsreaksjonsmedium, i organisk kjemi og petrokjemiske prosesser som involverer reaksjoner så som nitrering, kondens og dehydrering, så vel som i petroleumsraffinering, hvor den brukes i raffinering, alkylering og rensing av rå destillater.
- I den uorganiske kjemiske industrien er bruken bemerkelsesverdig i produksjonen av TiO2-pigmenter, saltsyre og flussyre..
- I metallforedlingsindustrien brukes svovelsyre til beising av stål, utvasking av kobber, uran og vanadiummalmer i den hydrometallurgiske prosessering av mineraler, og til fremstilling av elektrolytiske bad for rensing og plating av metaller. jernholdig.
- Enkelte prosesser for fremstilling av tremasse i papirindustrien, produksjon av noen tekstiler, fremstilling av kjemiske fibre og garvning av hud krever også svovelsyre.
Direkte
- Sannsynligvis er den største bruken av svovelsyre, der svovel er innlemmet i sluttproduktet, i den organiske sulfoneringsprosessen, spesielt for produksjon av vaskemidler..
- Sulfonering spiller også en viktig rolle i å skaffe andre organiske kjemikalier og mindre legemidler..
- Blybatterier er et av de mest kjente svovelsyreholdige forbrukerproduktene, og utgjør bare en liten brøkdel av det totale svovelsyreforbruket..
- Under visse forhold brukes svovelsyre direkte i landbruket for rehabilitering av sterkt alkalisk jord, slik som de som finnes i ørkenregionene i det vestlige USA. Imidlertid er denne bruken ikke veldig viktig når det gjelder det totale volumet av svovelsyre som brukes..
Utviklingen av svovelsyreindustrien
Vitriol-prosess

Den eldste metoden for å oppnå svovelsyre er den såkalte "vitriolprosessen", som er basert på termisk nedbrytning av vitrioler, som er sulfater av forskjellige typer, av naturlig opprinnelse..
De persiske alkymistene, Jābir ibn Hayyān (også kjent som Geber, 721 - 815 e.Kr.), Razi (865 - 925 e.Kr.) og Jamal Din al-Watwat (1318 e.Kr.), inkluderte vitriol i mineralklassifiseringslistene..
Den første omtale av "vitriol-prosessen" vises i skrifter av Jabir ibn Hayyan. Da beskrev alkymistene St. Albert den store og Basilius Valentinus prosessen mer detaljert. Alun og chalcanthite (blå vitriol) ble brukt som råvarer.
På slutten av middelalderen ble svovelsyre oppnådd i små mengder i glassbeholdere, hvor svovel ble brent med salpeter i et fuktig miljø..
Vitriol-prosessen ble brukt i industriell skala fra 1500-tallet på grunn av større etterspørsel etter svovelsyre.
Vitriol av Nordhausen
Fokus for produksjonen var i den tyske byen Nordhausen (derfor begynte vitriolen å bli kalt "Nordhausen vitriol"), hvor jern (II) sulfat (grønn vitriol, FeSO4 - 7HtoO) som råvare, som ble oppvarmet, og det resulterende svoveltrioksyd ble blandet med vann for å oppnå svovelsyre (olje av vitriol).
Prosessen ble utført i bysse, hvorav noen hadde flere nivåer, parallelt, for å oppnå større mengder vitriololje..
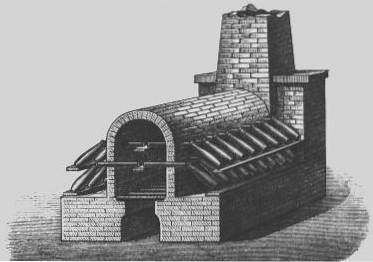
Lead Chambers
På 1700-tallet ble det utviklet en mer økonomisk prosess for produksjon av svovelsyre kjent som "blykammerprosessen".
Inntil da var den maksimale konsentrasjonen av syre oppnådd 78%, mens det med "vitriol-prosessen" ble oppnådd konsentrert syre og oleum, så denne metoden fortsatte å bli brukt i visse sektorer av industrien til utseendet til "kontaktprosessen" i 1870, hvor konsentrert syre kunne oppnås billigere.
Oleum eller røykende svovelsyre (CAS: 8014-95-7), er en løsning med oljeaktig konsistens og mørkebrun farge, med en variabel sammensetning av svoveltrioksid og svovelsyre, som kan beskrives med formelen HtoSW4.xSO3 (hvor x representerer det frie molare innholdet av svoveloksid (VI)). En verdi for x på 1 gir den empiriske formelen HtoStoELLER7, tilsvarer disulfuric acid (eller pyrosulfuric acid).
Prosess
Blykammerprosessen var den industrielle metoden som ble brukt til å produsere svovelsyre i store mengder, før den ble fortrengt av "kontaktprosessen".
I 1746 i Birmingham, England, begynte John Roebuck å produsere svovelsyre i blyforede kamre, som var sterkere og billigere enn tidligere brukte glassbeholdere, og som kunne gjøres mye større.
Svoveldioksid (fra forbrenning av elementært svovel eller metalliske mineraler som inneholder svovel, slik som pyritt) ble introdusert med damp og nitrogenoksid i store kamre foret med blyplater..
Svoveldioksydet og nitrogendioksydet ble oppløst, og i løpet av en periode på ca. 30 minutter ble svoveldioksidet oksidert til svovelsyre..
Dette tillot effektiv industrialisering av svovelsyreproduksjonen, og med forskjellige forbedringer forble denne prosessen standard produksjonsmetode i nesten to århundrer..
I 1793 oppnådde Clemente og Desormes bedre resultater ved å introdusere ekstra luft i blykammerprosessen..
I 1827 introduserte Gay-Lussac en metode for å absorbere nitrogenoksider fra avgassene i blykammeret..
I 1859 utviklet Glover en metode for utvinning av nitrogenoksider fra nydannet syre, ved stripping med varme gasser, som gjorde det mulig å utføre nitrogenoksydkatalysasjonsprosessen kontinuerlig..
I 1923 introduserte Petersen en forbedret tårnprosess som tillot den å være konkurransedyktig med kontaktprosessen frem til 1950-tallet..
Kammerprosessen ble så robust at den i 1946 fremdeles representerte 25% av verdens produksjon av svovelsyre..
Nåværende produksjon: kontaktprosess
Kontaktprosessen er den nåværende metoden for å produsere svovelsyre i høye konsentrasjoner, nødvendig i moderne industrielle prosesser. Platina pleide å være katalysator for denne reaksjonen. Imidlertid foretrekkes nå vanadiumpentoksyd (V2O5).
I 1831, i Bristol, England, patenterte Peregrine Phillips oksidasjon av svoveldioksid til svoveltrioksid ved hjelp av en platinakatalysator ved forhøyede temperaturer..
Imidlertid begynte oppfinnelsen hans, og den intensive utviklingen av kontaktprosessen, først etter at etterspørselen etter oleum for fremstilling av fargestoff økte fra omkring 1872 og utover..
Deretter ble det undersøkt bedre faste katalysatorer, og kjemien og termodynamikken til SO2 / SO3-likevekten ble undersøkt..
Kontaktprosessen kan deles inn i fem trinn:
- Kombinasjon av svovel og dioksygen (O2) for å danne svoveldioksid.
- Rensing av svoveldioksid i en renseenhet.
- Tilsetning av overflødig dioksygen til svoveldioksid i nærvær av vanadinpentoksydkatalysator, ved temperaturer på 450 ° C og et trykk på 1-2 atm.
- Det dannede svoveltrioksydet tilsettes svovelsyren som gir opphav til olje (svovelsyre).
- Olje tilsettes deretter til vannet for å danne svovelsyre som er sterkt konsentrert..
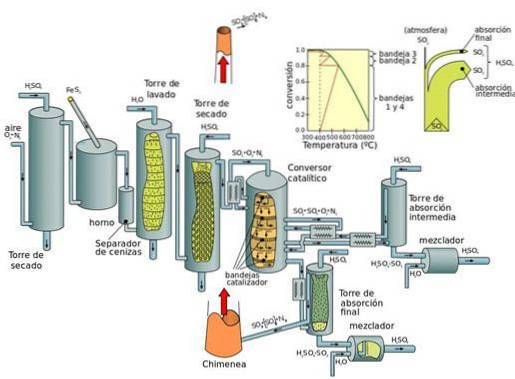
Den grunnleggende ulempen med nitrogenoksidprosesser (under blykammerprosessen) er at konsentrasjonen av svovelsyre som oppnås er begrenset til maksimalt 70 til 75%, mens kontaktprosessen produserer konsentrert syre (98%).
Med utviklingen av relativt billige vanadiumkatalysatorer for kontaktprosessen, kombinert med den økende etterspørselen etter konsentrert svovelsyre, falt den globale produksjonen av svovelsyre i nitrogenoksidbehandlingsanlegg jevnt og trutt..
I 1980 ble det nesten ikke produsert noen syre i nitrogenoksidbehandlingsanlegg i Vest-Europa og Nord-Amerika.
Dobbel kontaktprosess
Dobbeltabsorpsjons-dobbeltabsorpsjonsprosessen (DCDA eller Double Contact Double Absorption) introduserte forbedringer i kontaktprosessen for produksjon av svovelsyre.
I 1960 søkte Bayer patent på den såkalte dobbeltkatalyseprosessen. Det første anlegget som brukte denne prosessen ble startet i 1964.
Ved å innlemme et SO absorpsjonstrinn3 Før de siste katalytiske trinnene tillot den forbedrede kontaktprosessen en betydelig økning i SO-konvertering.to , redusere utslippene til atmosfæren betydelig.
Gassene føres tilbake gjennom den siste absorpsjonskolonnen, og oppnår ikke bare en høy SO-konverteringsytelseto til SÅ3 (på ca. 99,8%), men tillater også produksjon av en høyere konsentrasjon av svovelsyre.
Den vesentlige forskjellen mellom denne prosessen og den vanlige kontaktprosessen er i antall absorpsjonstrinn..
Fra og med 1970-tallet innførte de viktigste industrilandene strengere regler for beskyttelse av miljøet, og den doble overtakelsesprosessen ble mer utbredt i nye anlegg. Imidlertid er den konvensjonelle kontaktprosessen fortsatt brukt i mange utviklingsland med mindre strenge miljøstandarder..
Den største drivkraften for den nåværende utviklingen av kontaktprosessen er fokusert på å øke utvinningen og utnyttelsen av den store mengden energi produsert i prosessen..
Faktisk kan et stort moderne svovelsyreanlegg ikke bare sees på som et kjemisk anlegg, men også som et termisk kraftverk..
Råvarer som brukes i produksjonen av svovelsyre
Pyritt
Pyritt var det dominerende råmaterialet i produksjonen av svovelsyre til midten av 1900-tallet, da store mengder elementært svovel begynte å bli utvunnet fra oljeraffineringsprosessen og rensing av naturgass, og ble den viktigste materialindustriens premie.
Svoveldioksid
For tiden oppnås svoveldioksid ved forskjellige metoder, fra forskjellige råvarer.
I USA har industrien siden de første årene av det 20. århundre vært basert på å skaffe elementært svovel fra underjordiske avsetninger ved "Frasch-prosessen"..
Moderat konsentrert svovelsyre produseres også ved rekonsentrering og rensing av store mengder svovelsyre oppnådd som et biprodukt fra andre industrielle prosesser..
Gjenvinning
Resirkulering av denne syren blir stadig viktigere sett fra miljøet, spesielt i de viktigste utviklede landene..
Fremstillingen av svovelsyre basert på elementært svovel og pyritt er selvfølgelig relativt følsom for markedsforhold, siden syren produsert av disse materialene representerer et primært produkt..
I motsetning til dette, når svovelsyre er et biprodukt, produsert som et middel for å fjerne avfall fra en annen prosess, er ikke produksjonsnivået diktert av forholdene i svovelsyremarkedet, men av markedsforholdene for det primære produktet.
Kliniske effekter
-Svovelsyre brukes i industrien og i noen rengjøringsmidler til husholdninger, for eksempel rengjøringsmidler for baderom. Brukes også i batterier.
-Bevisst inntak, spesielt av høykonsentrerte produkter, kan forårsake alvorlig personskade og død. Disse inntaksexponeringene er sjeldne i USA, men er vanlige i andre deler av verden..
-Det er en sterk syre som forårsaker vevskader og proteinkoagulering. Det er etsende for hud, øyne, nese, slimhinner, luftveier og mage-tarmkanaler eller noe vev det kommer i kontakt med..
-Alvorlighetsgraden av skaden bestemmes av konsentrasjonen og varigheten av kontakten.
-Mildere eksponeringer (konsentrasjoner mindre enn 10%) forårsaker bare irritasjon av huden, øvre luftveier og mage-tarmslimhinnen.
-Åndedrettseffektene av akutt eksponering for innånding inkluderer: irritasjon i nese og hals, hoste, nysing, refleks bronkospasme, dyspné og lungeødem. Død kan oppstå fra plutselig sirkulasjonskollaps, glottisødem og luftveisinvolvering eller akutt lungeskade.
-Svelging av svovelsyre kan forårsake øyeblikkelig smerte i epigastrene, kvalme, spytt og oppkast av slimete eller blødende materiale som ser ut som "kaffegrut". Noen ganger observeres oppkast av ferskt blod.
-Svelging av konsentrert svovelsyre kan føre til korrosjon av spiserøret, nekrose og perforering av spiserøret eller magen, spesielt i pylorus. Noen ganger blir det sett skade på tynntarmen. Senere komplikasjoner kan inkludere stenose og fisteldannelse. Etter inntak kan metabolsk acidose utvikle seg.
-Alvorlige hudforbrenninger kan oppstå ved nekrose og arrdannelse. Disse kan være dødelige hvis et stort nok område av kroppsoverflaten påvirkes..
-Øyet er spesielt følsomt for korrosjonsskader. Irritasjon, rive og konjunktivitt kan utvikle seg selv med lave konsentrasjoner av svovelsyre. Sprut med svovelsyre i høye konsentrasjoner forårsaker: hornhinneforbrenning, tap av syn og sporadisk perforering av kloden.
-Kronisk eksponering kan være assosiert med endringer i lungefunksjonen, kronisk bronkitt, konjunktivitt, emfysem, hyppige luftveisinfeksjoner, gastritt, erosjon av tannemalje og muligens kreft i luftveiene..
Sikkerhet og risiko
Faresetninger fra det globalt harmoniserte systemet for klassifisering og merking av kjemikalier (GHS)
Globalt harmonisert system for klassifisering og merking av kjemikalier (GHS) er et internasjonalt avtalt system, opprettet av FN designet for å erstatte de forskjellige klassifiserings- og merkingsstandardene som brukes i forskjellige land ved å bruke konsistente kriterier på globalt nivå (Nations United, 2015 ).
Fareklassene (og deres tilsvarende GHS-kapittel), klassifiserings- og merkestandarder og anbefalinger for svovelsyre er som følger (European Chemicals Agency, 2017; FN, 2015; PubChem, 2017):
GHS fareklasser
H303: Kan være skadelig ved svelging [Advarsel Akutt giftighet, oral - Kategori 5] (PubChem, 2017).
H314: Gir alvorlige etseskader på huden og øyeskader [Fare Hudetsing / irritasjon - Kategori 1A, B, C] (PubChem, 2017).
H318: Gir alvorlig øyeskade [Fare Alvorlig øyeskade / øyeirritasjon - Kategori 1] (PubChem, 2017).
H330: Dødelig ved innånding [Fare Akutt giftighet, innånding - Kategori 1, 2] (PubChem, 2017).
H370: Forårsaker organskader [Fare Spesifikk målorgantoksisitet, enkelt eksponering - Kategori 1] (PubChem, 2017).
H372: Forårsaker organskader ved langvarig eller gjentatt eksponering [Fare Spesifikk målorgantoksisitet, gjentatt eksponering - Kategori 1] (PubChem, 2017).
H402: Skadelig for vannlevende organismer [Farlig for vannmiljøet, akutt fare - Kategori 3] (PubChem, 2017).
Sikkerhetskoder
P260, P264, P270, P271, P273, P280, P284, P301 + P330 + P331, P303 + P361 + P353, P304 + P340, P305 + P351 + P338, P307 + P311, P310, P312, P314, P320, P3 P363, P403 + P233, P405 og P501 (PubChem, 2017).
Referanser
- Arribas, H. (2012) Diagram over produksjonen av svovelsyre ved kontaktmetoden ved bruk av pyritt som råmateriale [image] Gjenopprettet fra wikipedia.org.
- Kjemisk økonomihåndbok, (2017). Svovelsyre. Gjenopprettet fra ihs.com.
- Chemical Economics Handbook, (2017.) Verdensforbruk av svovelsyre - 2013 [image]. Gjenopprettet fra ihs.com.
- ChemIDplus, (2017). 3D-struktur av 7664-93-9 - Svovelsyre [bilde] Gjenopprettet fra: chem.nlm.nih.gov.
- Codici Ashburnhamiani (1166). Portrett av "Geber" fra 1400-tallet. Laurenziana Medicea Library [bilde]. Gjenopprettet fra wikipedia.org.
- European Chemicals Agency (ECHA), (2017). Sammendrag av klassifisering og merking. Harmonisert klassifisering - Vedlegg VI til forordning (EF) nr. 1272/2008 (CLP-forordningen).
- Databank for farlige stoffer (HSDB). TOXNET. (2017). Svovelsyre. Bethesda, MD, EU: National Library of Medicine. Gjenopprettet fra: toxnet.nlm.nih.gov.
- Leyo (2007) Skjelettformel av svovelsyre [bilde]. Gjenopprettet fra: commons.wikimedia.org.
- Liebigs Extract of Meat Company (1929) Albertus Magnus, Chimistes Celebres [image]. Gjenopprettet fra: wikipedia.org.
- Müller, H. (2000). Svovelsyre og svoveltrioksid. I Ullmanns Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA. Tilgjengelig på: doi.org.
- FN (2015). Globalt harmonisert system for klassifisering og merking av kjemikalier (GHS) sjette reviderte utgave. New York, EU: FNs publikasjon. Gjenopprettet fra: unece.org.
- Nasjonalt senter for bioteknologisk informasjon. PubChem Compound Database, (2017). Svovelsyre - PubChem Structure. [image] Bethesda, MD, EU: National Library of Medicine. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov.
- Nasjonalt senter for bioteknologisk informasjon. PubChem Compound Database, (2017). Svovelsyre. Bethesda, MD, EU: National Library of Medicine. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Kjemisk datablad. Svovelsyre, brukt. Silver Spring, MD. EU; Gjenopprettet fra: cameochemicals.noaa.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Kjemisk datablad. Svovelsyre. Silver Spring, MD. EU; Gjenopprettet fra: cameochemicals.noaa.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Dataark for reaktiv gruppe. Syrer, sterk oksiderende. Silver Spring, MD. EU; Gjenopprettet fra: cameochemicals.noaa.gov.
- Oelen, W. (2011) Svovelsyre 96 prosent ekstra ren [image]. Gjenopprettet fra: wikipedia.org.
- Oppenheim, R. (1890). Schwefelsäurefabrik nach dem Bleikammerverfahren in der zweiten Hälfte des 19. Lehrbuch der Technischen Chemie [image]. Gjenopprettet fra: wikipedia.org.
- Priesner, C. (1982) Johann Christian Bernhardt und die Vitriolsäure, i: Chemie in unserer Zeit. [bilde]. Gjenopprettet fra: wikipedia.org.
- Stephanb (2006) Kobbersulfat [bilde]. Gjenopprettet fra: wikipedia.org.
- Stolz, D. (1614) Alkemisk diagram. Theatrum Chymicum [image] Gjenopprettet fra: wikipedia.org.
- Wikipedia, (2017). Svovelsyre. Gjenopprettet fra: wikipedia.org.
- Wikipedia, (2017). Svovelsyre. Gjenopprettet fra: wikipedia.org.
- Wikipedia, (2017). Bleikammerverfahren. Gjenopprettet fra: wikipedia.org.
- Wikipedia, (2017). Kontaktprosess. Gjenopprettet fra: wikipedia.org.
- Wikipedia, (2017). Blykammerprosess. Gjenopprettet fra: wikipedia.org.
- Wikipedia, (2017). Oleum. Gjenopprettet fra: https://en.wikipedia.org/wiki/Oleum
- Wikipedia, (2017). Oleum. Gjenopprettet fra: https://es.wikipedia.org/wiki/%C3%93leum
- Wikipedia, (2017). Svoveloksid Gjenopprettet fra: wikipedia.org.
- Wikipedia, (2017). Vitriol-prosess. Gjenopprettet fra: wikipedia.org.
- Wikipedia, (2017). Svoveldioksid. Gjenopprettet fra: wikipedia.org.
- Wikipedia, (2017). Svoveltrioksid. Gjenopprettet fra: wikipedia.org.
- Wikipedia, (2017). Svovelsyre. Gjenopprettet fra: wikipedia.org.
- Wikipedia, (2017). Vitriolverfahren. Gjenopprettet fra: wikipedia.org.
- Wright, J. (1770) Alchymisten, på jakt etter filosofens stein, oppdager fosfor og ber om en vellykket avslutning på hans operasjon, slik skikken var fra de eldgamle kymiske astrologene. [image] Gjenopprettet fra: wikipedia.org.



Ingen har kommentert denne artikkelen ennå.