
Natriumkloritt (NaClO2) struktur, egenskaper, bruksområder, risiko

De natriumkloritt er et uorganisk fast stoff dannet av et natriumion Na+ og en klorittion ClOto-. Den kjemiske formelen er NaClOto. Det er et hvitt krystallinsk fast stoff, i tillegg til å være et sterkt oksidasjonsmiddel. Derfor må det håndteres med stor forsiktighet..
Hovedbruken er som desinfiseringsmiddel for mange applikasjoner. Eliminerer mikrober på overflater som gulv, vegger og laboratorieutstyr på sykehus og klinikker og i deres vannsystemer.

Også i landbruks- og veterinæranlegg for å desinfisere inkubatorer for fjørfeeg, for å kontrollere infeksjoner i juver fra melkekyr, for å desinfisere vannsystemer for dyr osv..
I næringsmiddelindustrien brukes de forsurede vandige løsningene til å vaske kjøtt, kyllinger, frukt, grønnsaker, så vel som utstyret til slike anlegg..
Klordioksid kan tilberedes med natriumkloritt.to i stedet for bruk, som gjør det mulig å eliminere mikrober, dårlig lukt og smaker fra vannet slik at det er behagelig og kan drikkes uten problemer.
Det brukes også til å bleke papirmasse, vegetabilske tekstilfibre og oljer, blant andre applikasjoner..
NaClOto Fast stoff bør håndteres med forsiktighet, da det kan komme eksplosjoner i kontakt med visse materialer. Løsningene deres er litt lettere å håndtere, men er veldig oksiderende og etsende..
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Tetthet
- 3.5 Løselighet
- 3.6 Andre egenskaper
- 4 Risiko
- 5 Motta
- 6 bruksområder
- 6.1 Som et mikrobicid og desinfeksjonsmiddel i flere applikasjoner
- 6.2 Å desinfisere drikkevann
- 6.3 For pleie av kontaktlinser
- 6.4 I forskjellige applikasjoner
- 7 Referanser
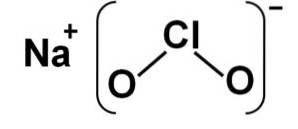
Struktur
Natriumkloritt består av en natriumkation Na+ og et klorittanion ClOto- derfor er de forbundet med en ionisk binding.
Klorittanionet har ett kloratom i en oksidasjonstilstand på +3 og to oksygenatomer med valens -2 hver. Av denne grunn har klorittanionet en negativ ladning..
Den har også en vinkelformet struktur.
Nomenklatur
- Natriumkloritt
- Natriumkloritt
- Klorsyrenatriumsalt
Eiendommer
Fysisk tilstand
Solid hvit krystallinsk.
Molekylær vekt
90,44 g / mol.
Smeltepunkt
Den spaltes når den smelter mellom 180 og 200 ºC.
Tetthet
2,468 g / cm3
Løselighet
Løselig i vann: 64 g / 100 g vann ved 17 ºC. Litt løselig i metanol.
Andre egenskaper
Det er litt hygroskopisk.
Det er et sterkt oksidasjonsmiddel. Reagerer voldsomt med brennbare og reduserende materialer. Reagerer voldsomt med syrer og genererer klordioksid ClOto.
Dens alkaliske løsninger (betyr i nærvær av for eksempel NaOH) er ganske stabile, mens det i et surt medium dannes klorsyre HClOto, som raskt går i stykker:
4 HClOto → 2 ClOto↑ + ClO3- + Cl- + 2 timer+ + HtoELLER
Risiko
Både NaClOto Fast som de vandige løsningene er potensielt farlige og krever stor forsiktighet og erfaring under håndtering og lagring..
NaClOto fast stoff kan eksplodere ved kontakt med organiske stoffer, inkludert hansker og klær, sølkontrollmaterialer som sagflis og bortkastet bomull, samt oljer og fett.
Den faste formen er derfor svært vanskelig å transportere, og det er foretrukket å bruke den i form av vandige oppløsninger..
Disse løsningene er ekstremt etsende. De bør fortrinnsvis holdes ved en pH over 8, det vil si en alkalisk pH.
NaClOto akselererer forbrenningen av brennbare forbindelser eller materialer, til det punktet at det kan danne eksplosive blandinger med dem.
Ved oppvarming avgir den giftige røyk av saltsyre HCl og natriumoksid NatoO. Langvarig eksponering for varme eller brann kan eksplodere.
Å skaffe
Den tilberedes startende med den kjemiske eller elektrokjemiske reduksjonen av natriumklorat NaClO3, i nærvær av saltsyre HCl for å produsere klordioksid ClOto.
Sistnevnte reageres med hydrogenperoksid HtoELLERto i vandig løsning av natriumhydroksyd NaOH og en løsning av natriumkloritt NaClO oppnåsto, som fordamper og det faste stoffet krystalliserer.
Det kan også oppnås ved å overføre klordioksydgass ClOto av en NaOH-løsning.
2 ClOto + 2 NaOH → NaClOto + NaClO3 + HtoELLER
applikasjoner
Som et mikrobicid og desinfeksjonsmiddel i flere applikasjoner
Det er en ingrediens i mange produkter som brukes til å kontrollere bakterier, sopp og algeslam. Produktene som inneholder det til dette formålet, brukes i landbruk, handel, industri og boliger eller hjem..
Fungerer som desinfeksjonsmiddel for mange typer materialer og overflater.
I landbruk, fjærfe og lignende næringer desinfiseres harde overflater, utstyr, anlegg for inkubering av fugleegg, drivhus for sopp som sopp og kjølevann og vannsystemer for fjørfehus..
Den har veterinær bruk som et aktuelt desinfeksjonsmiddel i kontrollen av mastitt av melkekyr, for å senke brystvortene til dyret. Mastitt er en infeksjon i kyrets yver.

Det brukes også i naturlige forskningsinstitusjoner for å dekontaminere laboratorier.
Kommersiell, industriell og medisinsk bruk inkluderer desinfisering av ventilasjonssystemer, harde overflater (som gulv, vegger, laboratorieutstyr) og vannsystemer..
I helsevesenet som klinikker og sykehus brukes det til å dekontaminere rom, korridorer, isolasjonsområder og til sterilisering av materialer.
Det er også nyttig for desinfisering i virksomheter der folk gjennomgår helsebehandlinger med vann eller spa.
I næringsmiddelindustrien brukes det som et fumigant for å bevare mat.
Den brukes i form av forsuret natriumkloritt. Dette produseres ved å tilsette matkvalitetssyre (for eksempel sitronsyre, fosforsyre, eplesyre eller natriumsyresulfat) til en vandig løsning av natriumkloritt..
Forsuret natriumkloritt har antimikrobielle egenskaper og brukes som en spray- eller vaske- eller sugeoppløsning for kylling, kjøtt, grønnsaker, frukt og sjømat. Også i vann for å fryse kylling eller fjærfe.
I hjemmene tillater det desinfisering av harde overflater, som gulv og bad, varme- eller klimaanlegg og vannsirkulasjonssystemer i bassenget..


Det selges også i små poser sammen med andre forbindelser for å frigjøre gass og kontrollere lukt i hjemmet..
Å desinfisere drikkevann
Det brukes til rensing av drikkevann, fungerer som et oksidant, forbedrer smaken og lukten av drikkevann.
Natriumkloritt er mye brukt som en forløper for generering av klordioksid ClOto brukes til å behandle drikkevann til konsum, det vil si for å eliminere mikroorganismer, lukt og ubehagelig smak og kan drikkes.
Å generere ClOto HCl kan brukes:
5 NaClOto + 4 HCl → 4 ClOto↑ + 5 NaCl + 2HtoELLER
ClOto det er et antimikrobielt middel med høy oksiderende virkning og et bredt spekter. Det vil si at den virker mot et stort antall mikroorganismer.
Mikroorganismer inaktiveres fordi ClOto det forstyrrer viktige enzymer av disse og med proteinene i cellemembranene. Det har også fordelen at det ikke produserer organiske klorforbindelser som er giftige..
Det er natriumklorittabletter til salgs blandet med andre forbindelser som oppløses i vann og produserer umiddelbart ClOto på en kontrollert måte, og desinfiserer vannet.

Hovedproblemet med å behandle vann for å fjerne smaker og lukt med ClOto er at giftige kloritt- og kloratsalter kan dannes under behandlingen.
For pleie av kontaktlinser
NaClOto det er en del av løsningene som tjener til å desinfisere kontaktlinser.
En kombinasjon av NaClO brukesto og spor (veldig små mengder) av hydrogenperoksid HtoELLERto.
HtoELLERto stabiliserer ClOto som dannes, og kombinasjonen av begge er veldig effektiv mot bakterier, sopp og gjær. De resulterende produktene er natriumklorid NaCl, vann og oksygen, som er ufarlige, noe som betyr at de ikke er skadelige for øyet.
Når linsene fjernes fra løsningen, NaClOto Rest nedbrytes raskt til NaCl og Oto. Restperoksid irriterer ikke øyet. Derfor er disse løsningene veldig trygge.

I forskjellige applikasjoner
Natriumkloritt brukes til fremstilling av klordioksid ClOto for øyeblikkelig bruk i et stort antall applikasjoner, hvorav noen ble diskutert i forrige avsnitt.
Den brukes til å bleke tremasse, tekstiler som bomull, vegetabilske fibre, spiselige og uspiselige oljer, fett, lakk, lakk og voks.
Det er en komponent av øyedråper og noen munnvannsløsninger..
Den brukes i lærforedlingsindustrien og i midler for galvanisering av metaller (metallbelegg).
Referanser
- Williams, L. et al. (2019). Mikrobiologi, linsepleie og vedlikehold. I kontaktlinser (sjette utgave). Gjenopprettet fra sciencedirect.com.
- OSS. National Library of Medicine. (2019). Natriumkloritt. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Gray, N.F. (2014). Klordioksid. Prosess teknologi. In Microbiology of Waterborne Diseases (Second Edition). Gjenopprettet fra sciencedirect.com.
- McKeen, L. (2012). Introduksjon til matbestråling og medisinsk sterilisering. Klordioksid. In The Effect of Sterilization on Plastic and Elastomers (Tredje utgave). Gjenopprettet fra sciencedirect.com.
- Ortenberg, E. og Telsch, B. (2003). Smak og luktproblemer i drikkevann. I håndbok for vann- og avløpsvannmikrobiologi. Gjenopprettet fra sciencedirect.com.
- Karsa, D.R. (2007). Biocider. Klordioksid. I håndbok for rengjøring / dekontaminering av overflater. Gjenopprettet fra sciencedirect.com.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte utgave. VCH Verlagsgesellschaft mbH.


Ingen har kommentert denne artikkelen ennå.