
Klorbenzen (C6H5Cl) Struktur, egenskaper, syntese
De klorbenzen er en aromatisk forbindelse med kjemisk formel C6H5Cl, spesielt et aromatisk halogenid. Ved romtemperatur er det en fargeløs, brennbar væske, som ofte brukes som løsningsmiddel og avfettingsmiddel. I tillegg tjener den som råmateriale for fremstilling av mange svært nyttige kjemiske forbindelser..
I forrige århundre fungerte det som grunnlag for syntesen av insektmidlet DDT, veldig nyttig ved utryddelse av sykdommer som malaria. Imidlertid ble bruken forbudt i 1970 på grunn av dens høye toksisitet for mennesker. Klorbenzenmolekylet er polært på grunn av en høyere elektronegativitet av klor i forhold til karbonatomet som det binder til.
Dette resulterer i at klor har en moderat tetthet av negativ ladning δ- i forhold til karbon og resten av den aromatiske ringen. På samme måte er klorbenzen praktisk talt uoppløselig i vann, men det er løselig i væsker av aromatisk kjemisk art, slik som: kloroform, benzen, aceton, etc..
I tillegg er Rhodococus phenolicus en bakteriell art som er i stand til å nedbryte klorbenzen som den eneste karbonkilden..
Artikkelindeks
- 1 Kjemisk struktur
- 2 Kjemiske egenskaper
- 2.1 Lukt
- 2.2 Molekylvekt
- 2.3 Kokepunkt
- 2.4 Smeltepunkt
- 2.5 Flammepunkt
- 2.6 Løselighet i vann
- 2.7 Løselighet i organiske forbindelser
- 2.8 Tetthet
- 2.9 Damptetthet
- 2.10 Damptrykk
- 2.11 Selvantennelse
- 2.12 Viskositet
- 2.13 Korrosivitet
- 2.14 Forbrenningsvarme
- 2.15 Fordampningsvarme
- 2.16 Overflatespenning
- 2.17 Ioniseringspotensial
- 2.18 Luktterskel
- 2.19 Eksperimentelt frysepunkt
- 2.20 Stabilitet
- 3 Syntese
- 4 Søknader
- 4.1 Bruk i organisk syntese
- 4.2 Bruk for syntese av organiske løsningsmidler
- 4.3 Legemiddelbruk
- 5 Referanser
Kjemisk struktur
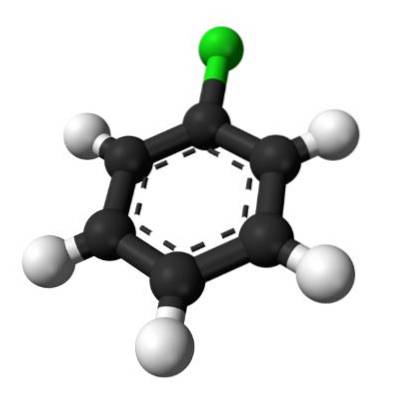
Det øvre bildet illustrerer strukturen til klorbenzen. De svarte kulene av karbon utgjør den aromatiske ringen, mens de hvite kulene og de grønne kulene utgjør hydrogen- og kloratomer, tilsvarende.
I motsetning til benzenmolekylet har klorbenzen et dipolmoment. Dette er fordi Cl-atomet er mer elektronegativ enn resten av de hybridiserte karbonene.to.
Av denne grunn er det ikke en jevn fordeling av elektrondensitet i ringen, men det meste er rettet mot Cl-atomet..
I følge denne forklaringen kan det med et elektrontetthetskart bekreftes at selv om det er svakt, er det en region δ-rik på elektroner.
Følgelig interagerer klorbenzenmolekyler med hverandre gjennom dipol-dipolkrefter. Imidlertid er de ikke sterke nok til at denne forbindelsen eksisterer i fast fase ved romtemperatur; av denne grunn er det en væske (men med et høyere kokepunkt enn benzen).
Kjemiske egenskaper
Lukt
Lukten er mild, ikke ubehagelig og ligner på mandel.
Molekylær vekt
112,556 g / mol.
Kokepunkt
131,6 ° C (770 ° F) ved 760 mmHg trykk.
Smeltepunkt
-45,2 ºC (-49 ºF)
Flammepunkt
27 ºC (82 ºF)
Vannløselighet
499 mg / l ved 25 ºC.
Løselighet i organiske forbindelser
Det er blandbart med etanol og etyleter. Det er veldig løselig i benzen, karbontetraklorid, kloroform og karbondisulfid.
Tetthet
1,1058 g / cm3 ved 20 ° C (1,11 g / cm3 ved 68 ° F). Det er en væske som er litt tettere enn vann.
Damptetthet
3,88 i forhold til luft. 3,88 (luft = 1).
Damptrykk
8,8 mmHg ved 68 ° F; 11,8 mmHg ved 77 ° F; 120 mmHg ved 25 ºC.
Selvantennelse
593 ºC (1.099 ºC)
Viskositet
0,806 mPoise ved 20 ºC.
Korrosivitet
Angriper noen typer plast, gummi og noen typer belegg.
Forbrenningsvarme
-3100 kJ / mol ved 25 ºC.
Fordampningsvarme
40,97 kJ / mol ved 25 ºC.
Overflatespenning
33,5 dyn / cm ved 20 ° C.
Ioniseringspotensial
9.07 eV.
Luktterskel
Anerkjennelse i luft 2.1.10-1 ppm. Lav lukt: 0,98 mg / cm3; høy lukt: 280 mg / cm3.
Eksperimentelt frysepunkt
-45,55 ° C (-50ºF).
Stabilitet
Det er uforenlig med oksidasjonsmidler.
Syntese
I industrien brukes metoden introdusert i 1851, hvor klorgass (Clto) gjennom det flytende benzen ved en temperatur på 240 ºC i nærvær av jernklorid (FeCl3), som fungerer som en katalysator.
C6H6 => C6H5Cl
Klorbenzen fremstilles også av anilin i Sandmayer-reaksjonen. Anilin danner benzenediazoniumklorid i nærvær av natriumnitritt; og benzenediazoniumklorid danner benzenklorid i nærvær av kobberklorid.
applikasjoner
Bruker i organisk syntese
-Det brukes som et løsningsmiddel, avfettingsmiddel og fungerer som et råmateriale for utarbeidelse av mange meget nyttige forbindelser. Klorbenzen ble brukt i syntesen av insektmidlet DDT, for tiden i bruk på grunn av dets toksisitet for mennesker.
-Selv om klorbenzen i mindre grad brukes i syntesen av fenol, en forbindelse som har soppdrepende, bakteriedrepende, insektdrepende, antiseptisk virkning, og som også brukes i produksjonen av agrokjemikalier, så vel som i produksjonsprosessen av acetisalisylsyre..
-Det er involvert i produksjonen av diisocyanat, et avfettingsmiddel for bildeler.
-Det brukes til å oppnå p-nitroklorbenzen og 2,4-dinitroklorbenzen.
-Det brukes i syntesen av forbindelsene trifenylfosfin, tiofenol og fenylsilan.
-Trifenylfosfin brukes i syntesen av organiske forbindelser; tiofenol er et plantevernmiddel og farmasøytisk mellomprodukt. I stedet brukes fenylsilan i silikonindustrien.
-Det er en del av råmaterialet for fremstilling av difenyloksid, som brukes som varmeoverføringsmiddel, til bekjempelse av plantesykdommer og til fremstilling av andre kjemiske produkter..
-P-nitroklorbenzen oppnådd fra klorbenzen er en forbindelse som brukes som et mellomprodukt ved fremstilling av fargestoffer, pigmenter, legemidler (paracetamol) og i gummikjemi.
Bruk for syntese av organiske løsningsmidler
Klorbenzen brukes også som råmateriale for fremstilling av løsemidler som brukes i syntesereaksjoner av organiske forbindelser, slik som metylendifenyldiisocyanat (MDI) og uretan..
MDI er involvert i syntesen av polyuretan, som oppfyller mange funksjoner i produksjonen av byggevarer, kjøleskap og frysere, sengemøbler, fottøy, biler, belegg og lim og andre applikasjoner.
På samme måte er uretan et råmateriale for produksjon av adjuvansforbindelser for landbruk, maling, blekk og rengjøringsmidler for bruk i elektronikk..
Medisinsk bruk
-2,4-dinitroklorbenzen har blitt brukt i dermatologi ved behandling av alopecia areata. Det har også blitt brukt i allergistudier og i immunologi av dermatitt, vitiligo og i prognosen for evolusjonen hos pasienter med ondartet melanom, kjønnsvorter og vanlige vorter..
-Det har hatt terapeutisk bruk hos pasienter med HIV. På den annen side har det blitt tilskrevet immunmodulerende funksjoner, et aspekt som er gjenstand for diskusjon..
Referanser
- Dra. Alessandra B. Alió S. (1998). Dinitrochlorbenzen og dets applikasjoner. [PDF]. Venezuelansk dermatologi, VOL. 36, nr. 1.
- Panoli Intermediates India Private Limited. Para-nitro klorbenzen (PNCB). Hentet 4. juni 2018 fra: panoliindia.com
- Korry Barnes. (2018). Klorbenzen: Egenskaper, reaktivitet og bruksområder. Hentet 4. juni 2018 fra: study.com
- Wikipedia. (2018). Klorbenzen. Hentet 4. juni 2018 fra: en.wikipedia.org
- PubChem. (2018). Klorbenzen. Hentet 4. juni 2018 fra: pubchem.ncbi.nlm.nih.gov



Ingen har kommentert denne artikkelen ennå.