
Kromklorid (CrCl3) struktur, egenskaper, bruksområder
De kromklorid (CrCl3) er et uorganisk salt sammensatt av Cr-kationer3+ og Cl-anioner- i forholdet 1: 3; det vil si for hver Cr3+ det er tre Cl-. Som det vil sees senere, er deres interaksjoner ikke ioniske. Dette saltet kan presenteres i to former: vannfritt og heksahydrat..
Den vannfrie formen er preget av å ha en rød-fiolett farge; mens heksahydratet, CrCl3.6HtoEller den er mørkegrønn. Inkorporeringen av vannmolekylene modifiserer de fysiske egenskapene til nevnte krystaller; som kokepunkt og smeltepunkter, tettheter osv..

Krom (III) klorid (i henhold til stamnomenklaturen) spaltes ved høye temperaturer og omdannes til krom (II) klorid, CrClto. Det er etsende for metaller, selv om det brukes i forkromning: en prosedyre der metaller er belagt med et tynt lag av krom.
Cr3+, Kommer fra sitt respektive klorid, har det blitt brukt til behandling av diabetes, spesielt hos pasienter med total parenteral ernæring (TPN), som ikke inntar den nødvendige mengden krom. Resultatene er imidlertid mye bedre (og mer pålitelige) hvis de leveres som pikolinat..
Artikkelindeks
- 1 Struktur av kromklorid
- 1.1 Krystallinske lag av vannfri
- 2 eiendommer
- 2.1 Navn
- 2.2 Kjemisk formel
- 2.3 Molekylvekt
- 2.4 Fysisk beskrivelse
- 2.5 Smeltepunkt
- 2.6 Kokepunkt
- 2.7 Løselighet i vann
- 2.8 Løselighet i organiske løsningsmidler
- 2,9 Tetthet
- 2.10 Lagringstemperatur
- 2.11 Nedbrytning
- 2.12 Korrosjon
- 2.13 Reaksjoner
- 2,14 pH
- 3 Syntese
- 4 bruksområder
- 4.1 Industriell
- 4.2 Terapi
- 5 risikoer
- 6 Referanser
Kromkloridstruktur
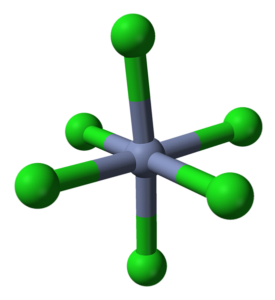
CrCl3 Til tross for at det er et salt, er ikke interaksjonens natur rent ionisk; har en viss kovalent karakter, produkt av koordineringen mellom Cr3+ og Cl-, som gir opphav til en deformert oktaeder (øvre bilde). Krom er plassert i midten av oktaedronet, og klor i toppunktene.
Oktaeder CrCl6 kan ved første øyekast stride mot CrCl-formelen3; Imidlertid definerer denne komplette oktaedronen ikke enhetscellen til krystallet, men snarere en terning (også deformert), som skjærer de grønne kulene eller kloranionene i to.
Vannfrie krystallinske lag
Dermed opprettholder enhetscellen med denne oktaedronen fortsatt forholdet 1: 3. Ved å reprodusere disse deformerte terningene i rommet, oppnås CrCl-krystall3, som er representert i det øvre bildet med en tredimensjonal fyllingsmodell, og en modell av kuler og stenger.

Dette krystallinske laget er et av mange som utgjør de flassende rødviolette krystallene til CrCl.3 (ikke forveksle fargen på krystall, sant, med den på de grønne kulene).
Som man kan se, er anionene Cl- de okkuperer overflaten, så deres negative ladninger frastøter de andre krystallinske lagene. Følgelig blir krystallene flassete og sprø; men skinnende på grunn av krom.
Hvis de samme lagene visualiseres fra et lateralt perspektiv, vil det bli observert, i stedet for oktaeder, forvrengt tetraeder:
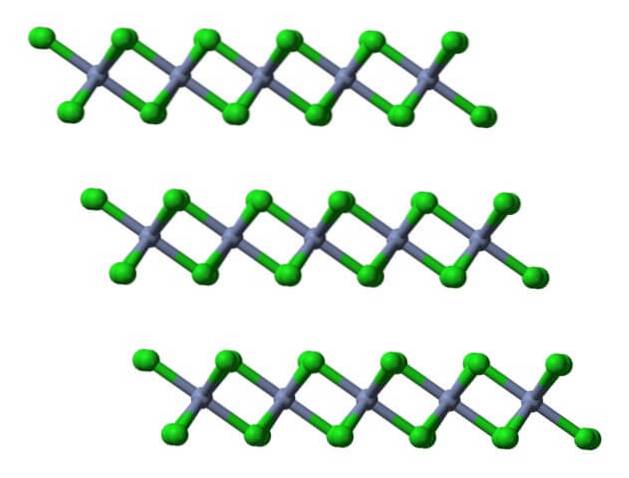
Her blir det lettere å forstå hvorfor lagene frastøter hverandre når Cl-anioner binder.- av overflatene.
Eiendommer
Navn
-Krom (III) klorid
-Krom (III) triklorid
-Vannfri krom (III) klorid.
Kjemisk formel
-CrCl3 (vannfri).
-CrCl3.6HtoO (heksahydrat).
Molekylær vekt
-158,36 g / mol (vannfri).
-266,43 g / mol (heksahydrat).
Fysisk beskrivelse
-Rødviolette faste stoffer og krystaller (vannfrie).
-Mørkegrønt krystallinsk pulver (heksahydrat, bunnbilde). I dette hydratet kan man se hvordan vann hemmer glans, en metallisk karakteristikk av krom.

Smeltepunkt
-1.152 ºC (2.106 ºF, 1.425 K) (vannfri)
-83 ºC (heksahydrat).
Kokepunkt
1300 ºC (2.370 ºF, 1.570) (vannfri).
Vannløselighet
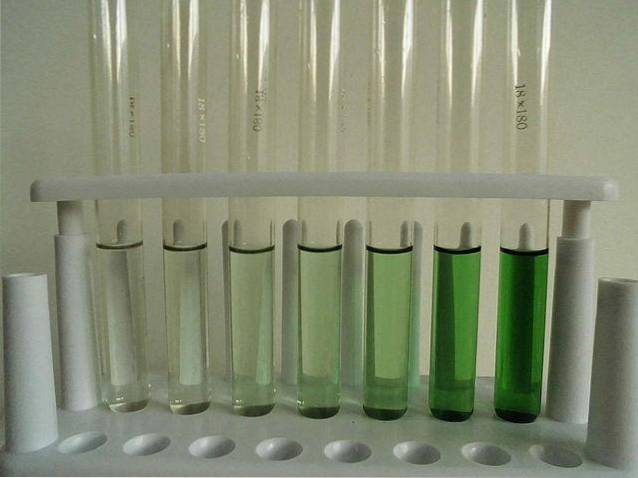
-Svakt løselig (vannfri).
-585 g / L (heksahydrat).
Bildet over viser en serie prøverør fylt med en vandig løsning av CrCl3. Merk at jo mer konsentrert det er, jo mer intens blir fargen på komplekset [Cr (OHto)6]3+, ansvarlig for den grønne fargen.
Løselighet i organiske løsningsmidler
Løselig i etanol, men uoppløselig i eter (vannfri).
Tetthet
-2,87 gr / cm3 (vannfri).
-2,76 g / cm3 (heksahydrat).
Lager temperatur
Nedbrytning
Ved oppvarming til nedbrytning avgir krom (III) klorid giftige røyk av klorholdige forbindelser. Disse forbindelsene frigjøres også når krom (III) klorid kommer i kontakt med sterke syrer..
Korrosjon
Det er veldig etsende og kan angripe visse stål.
Reaksjoner
Det er uforenlig med sterke oksidanter. Det reagerer også sterkt med litium og nitrogen..
Ved oppvarming i nærvær av hydrogen reduseres det til krom (II) klorid, med dannelse av hydrogenklorid.
2 CrCl3 + Hto => 2 CrClto + 2 HC1
pH
I en vandig løsning, og med en konsentrasjon på 0,2 M: 2,4.
Syntese
Krom (III) kloridheksahydrat produseres ved å reagere kromhydroksid med saltsyre og vann.
Cr (OH)3 + 3 HCl + 3 HtoO => CrCl3.6HtoELLER
For å oppnå det vannfrie saltet oppvarmes CrCl deretter3.6HtoEller i nærvær av tionylklorid, SOClto, saltsyre og varme:
[Cr (HtoELLER)6] Cl3 + 6SOClto + ∆ → CrCl3 + 12 HCl + 6SOto
Alternativt kan CrCl3 oppnådd ved å føre klorgass over en blanding av krom og karbonoksid.
CrtoELLER3 + 3 C + Clto => 2 CrCl3 + 3 CO
Og til slutt, som den mest brukte metoden, er det å varme opp oksidet med et halogeneringsmiddel, slik som karbontetraklorid:
CrtoELLER3 + 3CCl4 + ∆ → 2CrCl3 + 3COClto
applikasjoner
Industriell
Kromklorid er involvert i in situ fremstilling av krom (II) klorid; reagens involvert i reduksjonen av alkylhalogenider og i syntesen av (E) -alkenylhalogenider.
-Den brukes i forkromingsteknikken. Dette består i å deponere, ved hjelp av galvanisering, et tynt lag med krom på metallgjenstander eller annet materiale med et dekorativt mål, og dermed øke motstanden mot korrosjon og også overflatehardheten..
-Den brukes som tekstilmordant, og fungerer som et bindeledd mellom fargematerialet og stoffene som skal farges. I tillegg brukes den som en katalysator for produksjon av olefiner og vanntettingsmidler..
Terapeutikk
Bruk av USP kromkloridtilskudd anbefales hos pasienter som bare får intravenøse løsninger, administrert for total parenteral ernæring (TPN). Derfor bare når disse pasientene ikke får alle ernæringsbehovene sine.
Krom (III) er en del av glukosetoleransefaktoren, en aktivator av insulinfremmende reaksjoner. Krom (III) antas å aktivere glukose-, protein- og lipidmetabolisme, noe som letter virkningen av insulin hos mennesker og dyr.
Krom er tilstede i mange matvarer. Men konsentrasjonen overstiger ikke 2 per porsjon, brokkoli er maten med det høyeste bidraget (11 µg). I tillegg er tarmabsorpsjonen av krom lav, med en verdi på 0,4 til 2,5% av inntatt mengde..
Dette gjør det vanskelig å etablere en diett for tilførsel av krom. I 1989 anbefalte National Academy of Sciences 50 til 200 µg / dag som et tilstrekkelig inntak av krom..
Risiko
Blant de mulige risikoene ved å konsumere dette saltet som kromtilskudd er:
-Alvorlige magesmerter.
-Unormal blødning, som kan variere fra vanskeligheter med å helbrede et sår, rødmer blåmerker eller mørkere avføring etter intern blødning.
-Irritasjoner i fordøyelsessystemet, forårsaker sår i mage eller tarm.
-Dermatitt
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Krom (III) klorid. Gjenopprettet fra: en.wikipedia.org
- Krom (III) klorid [PDF]. Gjenopprettet fra: alpha.chem.umb.edu
- PubChem. (2019). Kromkloridheksahydrat. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- National Institutes of Health. (21. september 2018). Krom: Faktaark om kosttilskudd. Gjenopprettet fra: ods.od.nih.gov
- Tomlinson Carole A. (2019). Kromklorid bivirkninger. Leaf Group Ltd. Gjenopprettet fra: healthfully.com



Ingen har kommentert denne artikkelen ennå.