
Hva er hydrolyse og eksempler på reaksjoner

De hydrolyse Det er en kjemisk reaksjon som kan forekomme i både uorganiske og organiske molekyler eller ioner, og som involverer deltakelse av vann for å bryte deres bånd. Navnet stammer fra gresk, 'hydro' av vann og 'lysis' av brudd.
Vannmolekylet, HtoEller det etablerer en likevekt med ionene av salter av svake syrer og baser, og dette konseptet vises for første gang i generelle studier av kjemi og analytisk kjemi. Det er derfor en av de enkleste kjemiske reaksjonene.
I flere eksempler på hydrolyse er vann alene ikke i stand til å bryte en viss kovalent binding. Når dette skjer, akselereres eller katalyseres prosessen ved forsuring eller alkalisering av mediet; det vil si i nærvær av H-ioner3ELLER+ u OH-, henholdsvis. På samme måte er det enzymer som katalyserer hydrolyse.
Hydrolyse inntar et spesielt sted når det gjelder biomolekyler, siden bindingene som holder monomerer sammen er utsatt for hydrolyse under visse forhold. For eksempel hydrolyseres sukker for å bryte ned polysakkarider til deres bestanddel monosakkarider takket være virkningen av glukosidasenzymer.
Artikkelindeks
- 1 Hva er hydrolyse?
- 2 Eksempler på hydrolysereaksjoner
- 2.1 - ATP
- 2.2 - Vann
- 2.3 - Proteiner
- 2.4 - Amider og estere
- 2,5 - Syre-base
- 3 Referanser
Hva er hydrolyse?
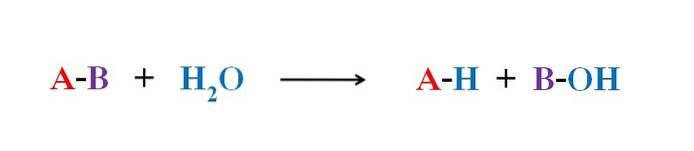
Bildet over forklarer hva hydrolyse består av. Vær oppmerksom på at ikke bare molekylet eller substratet (hvis enzymer medierer) bryter bindingen, men også selve vannet som "sprekker" inn i H+ og OH-, hvor H+ ender med A og OH- med B. A-B reagerer således med et vannmolekyl som produserer to produkter, A-H og B-OH.
Hydrolyse er derfor den motsatte reaksjonen på kondens. I kondensasjonen går to produkter, for å si A-H og B-OH, sammen ved frigjøring av et lite molekyl: vannet. I hydrolyse forbrukes et molekyl, mens det i kondens frigjøres eller produseres.
Tenk deg at A-B tilsvarer en sukrose dimer, der A representerer glukose, og B representerer fruktose. Bindingen A-B, glykosid, kan hydrolyseres for å stamme fra de to monosakkaridene hver for seg og i oppløsning, og det samme skjer med oligo og polysakkarider hvis enzymer medierer i slike reaksjoner..
Merk at i denne reaksjonen, A-B, har pilen bare en retning; det vil si at det er en irreversibel hydrolyse. Imidlertid er mange hydrolyse faktisk reversible reaksjoner som når en likevekt.
Eksempler på hydrolysereaksjoner
- ATP
ATP er stabil mellom pH-verdiene på 6,8 og 7,4. Imidlertid hydrolyserer den ved ekstreme pH-verdier spontant. Hos levende vesener katalyseres hydrolyse av enzymer kjent som ATPaser:
ATP + HtoO => ADP + Pi
Denne reaksjonen er sterkt eksergonisk, siden entropien til ADP er større enn ATP. Variasjonen av Gibbs fri energi (ΔGº) er - 30,5 kJ / mol. Energien som produseres ved hydrolyse av ATP brukes i mange endergoniske reaksjoner.
Sammenkoblede reaksjoner
I noen tilfeller brukes hydrolysen av ATP til omdannelse av en forbindelse (A) til en forbindelse (B).
A + ATP + HtoELLER <=> B + ADP + Pi + H+
- Vann
To vannmolekyler kan reagere med hverandre i tilsynelatende hydrolyse:
HtoO + HtoELLER <=> H3ELLER+ + Åh-
Det er som om et av disse vannmolekylene brøt seg inn i H+ og OH-, kommer til å koble H+ til oksygenatomet i det andre vannmolekylet, som gir opphav til hydroniumionet, H3ELLER+. Denne reaksjonen, mer enn hydrolyse, handler om autoionisering eller autoprotolyse av vann.
- Protein
Proteiner er stabile makromolekyler, og for å oppnå fullstendig hydrolyse, kreves ekstreme forhold i aminosyrene som utgjør dem; slik som en konsentrasjon av saltsyre (6 M) og høye temperaturer.
Imidlertid er levende vesener utstyrt med et enzymatisk arsenal som tillater hydrolyse av proteiner til aminosyrer i tolvfingertarmen. Enzymer som er involvert i fordøyelsen av proteiner, skilles nesten ut av bukspyttkjertelen.
Det er exopeptidaseenzymer som nedbryter proteiner, og begynner ved endene: aminopeptidase i aminoenden og karboksypeptidase i karboksylenden. Endopeptidase-enzymer utøver sin virkning inne i proteinkjeden, for eksempel: trypsin, pepsin, chymotrypsin, etc..
- Amider og estere
Når amider blir oppvarmet i et alkalisk medium, dannes en karboksylsyre og et amin:
RCONHto + HtoO => RCOO- + NHto
Estere i et vandig medium hydrolyseres til en karboksylsyre og en alkohol. Prosessen katalyseres av enten en base eller en syre:
RCO-OR '+ HtoO => RCOOH + R'OH
Dette er den berømte forsønningsreaksjonen.
- Syre-base
I vann hydrolyseres flere arter for å forsure eller alkalisere det vandige mediet.
Tilsett et grunnleggende salt
Natriumacetat, et basisk salt, dissosieres i vann for å gi Na-ioner+ (natrium) og CH3COO- (acetat). Dens grunnleggende grunn er at acetat hydrolyseres for å generere OH-ioner-, mens natrium forblir uendret:
CH3COO- + HtoELLER <=> CH3COOH + OH-
OH- er ansvarlig for at pH stiger og blir grunnleggende.
Tilsett et syresalt
Ammoniumklorid (NH4Cl) dannes av kloridionet (Cl-) fra saltsyre (HCl), en sterk syre og ammoniumkation (NH4+) fra ammoniumhydroksyd (NH4OH), en svak base. Cl- Den dissosieres ikke i vann, men ammoniumkationen forvandles til vann som følger:
NH4+ + HtoELLER <=> NH3 + H3ELLER+
Hydrolysen av ammoniumkationen produserer protoner som øker surheten til et vandig medium, så det konkluderes med at NH4Cl er et surt salt.
Tilsett et nøytralt salt
Natriumklorid (NaCl) er et saltprodukt fra reaksjonen av en sterk base (NaOH) med en sterk syre (HCl). Ved å oppløse natriumklorid i vann, vil natriumkationen (Na+) og anionet (Cl-). Begge ionene skiller seg ikke ut i vann, så de tilfører ikke H+ u OH-, holder pH konstant.
Derfor sies det at natriumklorid er et nøytralt salt..
Referanser
- Mathews, C. K., van Holde, K. E. og Ahern, K. G. (2002). Biokjemi. (Tredje utgave). Redigere. Pearson-Addison Wesley.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Helmenstine, Anne Marie, Ph.D. (13. januar 2019). Hydrolyse: Definisjon og eksempler. Gjenopprettet fra: thoughtco.com
- Theresa Phillips. (28. april 2019). En forklaring på prosessen med hydrolyse. Gjenopprettet fra: thebalance.com
- Redaksjonen av Encyclopaedia Britannica. (2016, 16. november). Hydrolyse. Encyclopædia Britannica. Gjenopprettet fra: britannica.com
- Wikipedia. (2019). Hydrolyse. Gjenopprettet fra: en.wikipedia.org



Ingen har kommentert denne artikkelen ennå.