
Bowmans kapselstruktur, histologi, funksjoner

De Bowmans kapsel representerer det første segmentet av den rørformede komponenten i nefronen, den anatomisk-funksjonelle enheten i nyrene der prosessene for produksjon av urin utføres og som nyrene bidrar til å bevare organismens homeostase.
Den ble kåret til ære for den engelske øyelegen og anatomisten Sir William Bowman, som oppdaget dens eksistens og publiserte sin histologiske beskrivelse for første gang i 1842..
Det er noe forvirring i litteraturen angående nomenklaturen for de første segmentene av nefronen, inkludert Bowmans kapsel. Noen ganger blir det beskrevet som en annen del av glomerulus og utgjør med den nyrekroppen, mens den for andre fungerer som et medlem av glomerulus.
Uansett om kapslen er en del av eller er en del av glomerulus i anatomiske beskrivelser, er faktum at begge elementene er så nært knyttet til sin struktur og funksjon at begrepet glomerulus våkner hos de som tenker på det, ideen om en liten kule med fartøyene..
Ellers ville kapselen ganske enkelt være en beholder som den filtrerte væsken helles i glomerulus i, men den ville ikke ha noen del i selve den glomerulære filtreringsprosessen. Noe som ikke er tilfelle, siden det, som det vil sees, er en del av den prosessen som den bidrar til på en spesiell måte.
Artikkelindeks
- 1 Struktur og histologi
- 2 funksjoner
- 3 Bestemmelser av størrelsen på glomerulær filtrering
- 3.1 Filtreringskoeffisient (Kf)
- 3.2 Effektivt filtreringstrykk (Peff)
- 4 Filtreringsindeks (IF) av stoffer som er tilstede i plasma
- 5 Referanser
Struktur og histologi
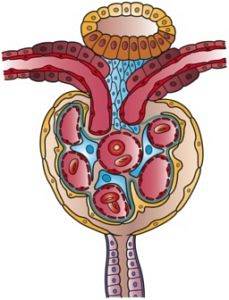
Bowmans kapsel er som en liten kule der veggen invaginerer i vaskulær sektor. I denne invaginasjonen blir kapslen trengt gjennom kapillærkulen, som har sin opprinnelse i den avferente arteriolen og tilfører blod til glomerulus, hvorfra den efferente arteriolen også kommer ut, som trekker blod fra glomerulus..
Den motsatte enden av kapselen, kalt urinpolen, ser ut som om kuleveggen hadde et hull som enden av det første segmentet som initierer selve den rørformede funksjonen er koblet til, det vil si den proksimale kronglede tubuli..
Denne ytre veggen av kapselen er et flatt epitel og kalles Bowmans kapsel parietalepitel. Endringer i struktur ved overgang til proksimalt tubuliepitel ved urinpolen og visceralt epitel ved vaskulærpolen.
Det invaginerte epitelet kalles visceralt fordi det omgir glomerulære kapillærer som om det var en innvoller. Den er dannet av celler som kalles podocytter som klemmer, dekker dem, kapillærene og har veldig spesielle egenskaper.
Podocyttene er organisert i et enkelt lag, og sender ut utvidelser som interdigiterer med utvidelsene til nabopodocytter, og etterlater mellomrom mellom dem kalt spalteporer eller filtreringsspalter, som er kontinuitetsløsninger for passering av filtratet..
Podocyttene og endotelcellene de dekker syntetiserer en kjellermembran som de hviler på, og som også har løsninger for kontinuitet for passering av vann og stoffer. Endotelceller er fenestrert og tillater også filtrering.
Så disse tre elementene: kapillærendotel, kjellermembran og visceralt epitel i Bowmans kapsel, utgjør sammen membranen eller filtreringsbarrieren..
Funksjoner
Kapselen er assosiert med glomerulær filtreringsprosess. På den ene siden fordi det er en del av epitelbelegget av podocytter som omgir glomerulære kapillærer. Det bidrar også til syntesen av kjellermembranen som dette epitelet og det glomerulære kapillære endotelet hviler på..
Disse tre strukturene: kapillærendotel, kjellermembran og visceralt epitel av Bowmans kapsel, utgjør den såkalte filtreringsmembranen eller barrieren, og hver av dem har sine egne permeabilitetsegenskaper som bidrar til den globale selektiviteten til den barrieren..
I tillegg bestemmer volumet av væske som trenger inn i Bowmans rom, sammen med graden av stivhet som er mot den ytre kapselveggen, tilblivelsen til et intrakapsulært trykk som bidrar til å modulere det effektive filtreringstrykket og til å drive væsken langs det tilhørende tubuli.
Bestemmelser av størrelsen på glomerulær filtrering
En variabel som samler størrelsen på den glomerulære filtreringsprosessen er det såkalte glomerulære filtreringsvolumet (GFR), som er volumet av væske som filtreres gjennom alle glomeruli i en tidsenhet. Den gjennomsnittlige normalverdien er omtrent 125 ml / min eller 180 l / dag.
Størrelsen på denne variabelen bestemmes fra det fysiske synspunkt av to faktorer, nemlig den såkalte filtrerings- eller ultrafiltreringskoeffisienten (Kf) og det effektive filtreringstrykket (Peff). Det vil si: VFG = Kf x Peff (ligning 1)
Filtreringskoeffisient (Kf)
Filtreringskoeffisienten (Kf) er produktet av den hydrauliske ledningsevnen (LP), som måler vannpermeabiliteten til en membran i ml / min per enhet enhet og drivtrykk, ganger overflatearealet (A) av filtreringsmembranen, det vil si Kf = LP x A (ligning 2).
Filtreringskoeffisientens størrelse angir volumet av væske som filtreres per tidsenhet og per enhet effektivt drivtrykk. Selv om det er veldig vanskelig å måle direkte, kan det fås fra ligning 1, som deler VFG / Peff.
Kf i glomerulære kapillærer er 12,5 ml / min / mmHg per c / 100 g vev, en verdi omtrent 400 ganger høyere enn Kf for andre kapillarsystemer i kroppen, hvor ca. 0,01 ml / ml kan filtreres. Min / mm Hg per 100 g vev. Sammenligning som viser glomerulær filtreringseffektivitet.
Effektivt filtreringstrykk (Peff)
Det effektive filtreringstrykket representerer resultatet av den algebraiske summen av de forskjellige trykkreftene som favoriserer eller motarbeider filtrering. Det er en hydrostatisk trykkgradient (ΔP) og en osmotisk trykkgradient (onkotisk, ΔП) bestemt av tilstedeværelsen av proteiner i plasmaet.
Den hydrostatiske trykkgradienten er trykkforskjellen mellom det indre av glomerulær kapillær (PCG = 50 mm Hg) og rommet til Bowmans kapsel (PCB = 12 mm Hg). Som det fremgår, rettes denne gradienten fra kapillæren til kapselen og fremmer fortrengning av væske i den retningen..
Den osmotiske trykkgradienten flytter væske fra lavere osmotisk trykk til høyere. Bare partikler som ikke filtrerer har denne effekten. Proteiner filtreres ikke. Dens ПCB er 0 og i glomerulær kapillær er ПCG 20 mm Hg. Denne gradienten flytter væske fra kapsel til kapillær.
Det effektive trykket kan beregnes ved å bruke Peff = ΔP-ΔП; = (PCG-PCB) - (ПCG-ПCB); = (50-12) - (20-0); = 38-20 = 18 mm Hg. Dermed er det et effektivt eller nettofiltrasjonstrykk på ca. 18 mm Hg som bestemmer en GFR på ca. 125 ml / min..
Filtreringsindeks (IF) av stoffer som er tilstede i plasma
Det er en indikator på hvor lett (eller vanskeligheter) et stoff i plasma kan krysse filtreringsbarrieren. Indeksen oppnås ved å dele konsentrasjonen av stoffet i filtratet (FX) med konsentrasjonen i plasmaet (PX), det vil si: IFX = FX / PX.
Området for IF-verdier er mellom maksimalt 1 for de stoffene som filtrerer fritt, og 0 for de som ikke filtrerer i det hele tatt. Mellomverdier er for partikler med mellomliggende vanskeligheter. Jo nærmere 1 verdien er, desto bedre blir filtreringen. Nærmere 0, vanskeligere å filtrere.
En av faktorene som bestemmer IF er størrelsen på partikkelen. De med diametere mindre enn 4 nm filtrerer fritt (IF = 1). Når størrelsen blir nærmere albumin, synker IF. Partikler av størrelse i albumin eller større har IF på 0.
En annen faktor som bidrar til å bestemme IF er negative elektriske ladninger på den molekylære overflaten. Proteiner er svært negativt ladede, noe som øker størrelsen deres for å gjøre det vanskelig å filtrere. Årsaken er at porene har negative ladninger som frastøter proteinene.
Referanser
- Ganong WF: Renal Function and Micturition, i Gjennomgang av medisinsk fysiologi, 25. utg. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: Urinary System, i Lærebok for medisinsk fysiologi , 13. utgave, AC Guyton, JE Hall (red.). Philadelphia, Elsevier Inc., 2016.
- Lang F, Kurtz A: Niere, i Physiologie des Menschen mit Pathophysiologie, 31. utgave, RF Schmidt et al (red.). Heidelberg, Springer Medizin Verlag, 2010.
- Silbernagl S: Die funksjon der nieren, in Fysiologi, 6. utgave; R Klinke et al (red.). Stuttgart, Georg Thieme Verlag, 2010.
- Stahl RAK et al: Niere und ableitende Harnwege, in Klinische Pathophysiologie, 8. utgave, W Siegenthaler (red). Stuttgart, Georg Thieme Verlag, 2001.


Ingen har kommentert denne artikkelen ennå.