
Sinkfingers struktur, klassifisering, funksjon og betydning
De sinkfingre (ZF) er strukturelle motiver som finnes i et stort antall eukaryote proteiner. De tilhører gruppen metalloproteiner, da de er i stand til å binde sinkmetallionen, som de trenger for deres drift. Mer enn 1500 ZF-domener antas å eksistere i rundt 1000 forskjellige proteiner hos mennesker..
Begrepet sinkfinger eller "sinkfinger" ble først laget i 1985 av Miller, McLachlan og Klug, mens de i detalj studerte de små DNA-bindende domenene til transkripsjonsfaktoren TFIIIA av Xenopus laevis, beskrevet av andre forfattere noen år før.
Proteiner med ZF-motiver er blant de mest utbredte i genomet til eukaryote organismer og deltar i en rekke viktige cellulære prosesser, inkludert gentranskripsjon, proteintranslasjon, metabolisme, folding og montering av andre proteiner og lipider., Programmert celledød, blant andre.
Artikkelindeks
- 1 Struktur
- 2 Klassifisering
- 2.1 C2H2
- 2.2 C2H
- 2.3 C4 (sløyfe eller bånd)
- 2.4 C4 (GATA-familie)
- 2.5 C6
- 2.6 Sinkfinger (C3HC4-C3H2C3)
- 2.7 H2C2
- 3 funksjoner
- 4 Bioteknologisk betydning
- 5 Referanser
Struktur
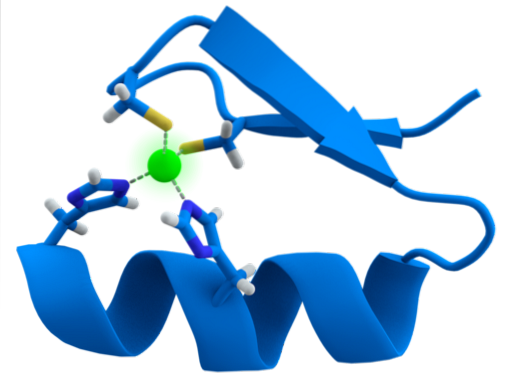
Strukturen til ZF-motivene er ekstremt bevart. Vanligvis har disse gjentatte områdene 30 til 60 aminosyrer, hvis sekundære struktur er funnet som to antiparallelle beta-ark som danner en hårnål og en alfa-helix, som er betegnet som ββα.
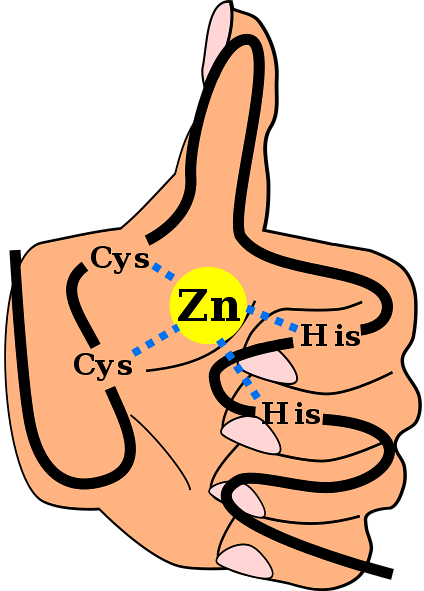
Nevnte sekundære struktur er stabilisert ved hydrofobe interaksjoner og ved koordinering av et sinkatom gitt av to cystein- og to histidinrester (CystoHansto). Imidlertid er det ZFer som kan koordinere mer enn ett sinkatom og andre der rekkefølgen på Cys og hans rester varierer..
ZFene kan bli funnet gjentatt i grupper, lineært konfigurert i det samme proteinet. Alle har lignende strukturer, men kan kjemisk skilles fra hverandre ved variasjoner av aminosyrerester som er nøkkelen til oppfyllelsen av deres funksjoner.
Et vanlig trekk blant ZF er deres evne til å gjenkjenne DNA- eller RNA-molekyler av forskjellige lengder, og det er derfor de først ble ansett som transkripsjonsfaktorer..
Generelt er gjenkjenning av 3bp-regioner i DNA og oppnås når proteinet med ZF-domene presenterer alfa-helixen til hovedsporet i DNA-molekylet.
Klassifisering
Det er forskjellige ZF-motiver som skiller seg fra hverandre på grunn av sin natur og de forskjellige romlige konfigurasjonene som oppnås ved koordineringsbåndene med sinkatomet. En av klassifiseringene er som følger:
CtoHto
Dette er et vanlig motiv i ZF-er. De fleste C-motivtoHto De er spesifikke for interaksjon med DNA og RNA, men de har blitt observert å delta i protein-protein-interaksjoner. De har mellom 25 og 30 aminosyrerester og finnes i den største familien av regulatoriske proteiner i pattedyrceller.
CtoH
De samhandler med RNA og noen andre proteiner. De observeres hovedsakelig som en del av noen retroviruscapsidproteiner, og hjelper til med pakking av viralt RNA like etter replikasjon..
C4 (sløyfe eller bånd)
Proteiner med dette motivet er enzymer som er ansvarlige for DNA-replikasjon og transkripsjon. Et godt eksempel på disse kan være de grove enzymene til fagene T4 og T7.
C4 (GATA-familie)
Denne ZF-familien består av transkripsjonsfaktorer som regulerer ekspresjon av viktige gener i mange vev under celleutvikling. Faktorer GATA-2 og 3 er for eksempel involvert i hematopoiesis.
C6
Disse domenene er typiske for gjær, spesielt GAL4-proteinet, som aktiverer transkripsjonen av gener som er involvert i bruken av galaktose og melibiose..
Sinkfingre (C3HC4-C3HtoC3)
Disse spesielle strukturene har to undertyper av ZF-domener (C3HC4 og C3HtoC3) og er til stede i mange animalske og planteproteiner.
De finnes i proteiner som RAD5, involvert i DNA-reparasjon i eukaryote organismer. De finnes også i RAG1, avgjørende for rekonfigurering av immunglobuliner.
HtoCto
Dette domenet til ZF er sterkt konservert i integrasene av retrovirus og retrotransposoner; ved å binde seg til målproteinet forårsaker det en konformasjonsendring i det.
Funksjoner
Proteiner med ZF-domener tjener forskjellige formål: de finnes i ribosomale proteiner eller i transkripsjonsadaptere. De har også blitt oppdaget som en integrert del av strukturen til gjær-RNA-polymerase II..
De ser ut til å være involvert i intracellulær sinkhomeostase og i reguleringen av apoptose eller programmert celledød. I tillegg er det noen proteiner med ZF som fungerer som kaperoner for folding eller transport av andre proteiner..
Binding til lipider og en grunnleggende rolle i protein-protein-interaksjoner er også fremtredende funksjoner til ZF-domenene i noen proteiner..
Bioteknologisk betydning
Gjennom årene har den strukturelle og funksjonelle forståelsen av ZF-domenene tillatt store vitenskapelige fremskritt som innebærer bruk av egenskapene til bioteknologiske formål..
Siden noen proteiner med ZF har høy spesifisitet for visse DNA-domener, investeres det for tiden mye arbeid i utformingen av spesifikke ZFer, noe som kan gi verdifulle fremskritt innen genterapi hos mennesker..
Interessante bioteknologiske applikasjoner oppstår også fra utformingen av proteiner med genetisk konstruerte ZF-er. Avhengig av ønsket formål kan noen av disse modifiseres ved tilsetning av "poly sink" fingerpeptider, som er i stand til å gjenkjenne praktisk talt enhver DNA-sekvens med høy affinitet og spesifisitet..
Nuklease-modifisert genomredigering er en av de mest lovende applikasjonene i dag. Denne typen redigering gir muligheten til å utføre studier på genetisk funksjon direkte i modellsystemet av interesse..
Genteknikk ved hjelp av modifiserte ZF-nukleaser har fanget oppmerksomhet fra forskere innen genetisk forbedring av kulturer av planter av agronomisk betydning. Disse nukleasene har blitt brukt til å korrigere et endogent gen som produserer herbicidresistente former i tobakkplanter..
Nukleaser med ZF har også blitt brukt for tilsetning av gener i pattedyrceller. De aktuelle proteinene ble brukt til å generere et sett med isogene museceller med en serie alleler definert for et endogent gen..
En slik prosess har en direkte anvendelse i merking og opprettelse av nye allelformer for å studere sammenhengen mellom struktur og funksjon under innfødte uttrykksbetingelser og i isogene miljøer..
Referanser
- Berg, J. M. (1990). Sinkfinger-domener: hypoteser og nåværende kunnskap. Årlig gjennomgang av biofysikk og biofysisk kjemi, 19(39), 405-421.
- Dreier, B., Beerli, R., Segal, D., Flippin, J., & Barbas, C. (2001). Utvikling av sinkfingerdomener for gjenkjenning av 5'-ANN-3 'familien av DNA-sekvenser og deres bruk i konstruksjonen av kunstige transkripsjonsfaktorer. JBC, (54).
- Gamsjaeger, R., Liew, C. K., Loughlin, F. E., Crossley, M., & Mackay, J. P. (2007). Klebrige fingre: sinkfinger som proteingjenkjenningsmotiver. Trender innen biokjemisk vitenskap, 32(2), 63-70.
- Klug, A. (2010). Oppdagelsen av sinkfingre og deres anvendelser i genregulering og genommanipulasjon. Årlig gjennomgang av biokjemi, 79(1), 213-231.
- Kluska, K., Adamczyk, J., & Krȩzel, A. (2017). Metallbindingsegenskaper til sinkfinger med et naturlig endret metallbindingssted. Metallomics, 10(2), 248-263.
- Laity, J. H., Lee, B. M., og Wright, P. E. (2001). Sinkfingerproteiner: Ny innsikt i strukturelt og funksjonelt mangfold. Nåværende mening i strukturell biologi, elleve(1), 39-46.
- Miller, J., McLachlan, A. D., & Klug, A. (1985). Gjentatte sinkbindende domener i proteintranskripsjonsfaktoren IIIA fra Xenopus-oocytter. Journal of Trace Elements in Experimental Medicine, 4(6), 1609-1614.
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., og Gregory, P. D. (2010). Genomredigering med konstruerte sinkfingernukleaser. Naturanmeldelser Genetikk, elleve(9), 636-646.
Ingen har kommentert denne artikkelen ennå.