
Halogenerte derivategenskaper, bruksområder og eksempler

De halogenerte derivater er alle de forbindelsene som har et halogenatom; det vil si noen av elementene i gruppe 17 (F, Cl, Br, I). Disse elementene skiller seg fra resten ved å være mer elektronegative og danne et mangfold av uorganiske og organiske halogenider..
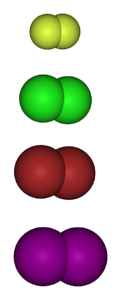
Bildet nedenfor viser de gasformige molekylene til halogenene. Fra topp til bunn: fluor (Ftoklor (Clto), brom (Brto) og jod (Ito). Hver av disse har evnen til å reagere med de aller fleste elementer, selv mellom kongenere i samme gruppe (interhalogener).
Halogenerte derivater har således formelen MX hvis det er et metallhalogenid, RX hvis det er alkyl og ArX hvis det er aromatisk. De to siste er i kategorien organiske halogenider. Stabiliteten til disse forbindelsene krever en "energifordel" sammenlignet med det opprinnelige gassmolekylet.
Som en generell regel danner fluor mer stabile halogenerte derivater enn jod. Årsaken skyldes forskjellene mellom deres atomare radier (de lilla kulene er mer omfangsrike enn de gule).
Når atomradiusen øker, er overlappingen av orbitalene mellom halogenet og det andre atomet dårligere, og derfor er bindingen svakere..
Artikkelindeks
- 1 Nomenklatur
- 1.1 Uorganiske stoffer
- 1.2 Organisk
- 2 eiendommer
- 2.1 Uorganiske halogenider
- 2.2 Organiske halogenider
- 3 bruksområder
- 4 Ytterligere eksempler
- 5 Referanser
Nomenklatur
Den riktige måten å navngi disse forbindelsene avhenger av om de er uorganiske eller organiske..
Uorganisk
Metallhalogenider består av en binding, ionisk eller kovalent, mellom et halogen X og et metall M (fra gruppe 1 og 2, overgangsmetaller, tungmetaller osv.).
I disse forbindelsene har alle halogener en oksidasjonstilstand på -1. Hvorfor? Fordi valensinnstillingene er nstonp5.
Derfor trenger de bare å skaffe seg ett elektron for å fullføre valensoktet, mens metaller oksiderer, og gir dem elektronene de har tilgjengelig..
Dermed forblir fluoren som F-, fluor; Cl-, klorid; BR-, bromid; og jeg-, Jeg Varer. MF vil bli kalt: (metallnavn) fluor (n), hvor n bare er valens av metallet når det har mer enn en. For metaller i gruppe 1 og 2 er det ikke nødvendig å navngi valensen.
Eksempler
- NaF: natriumfluorid.
- CaClto: kalsiumklorid.
- AgBr: sølvbromid.
- ZnIto: sinkjodid.
- CuCl: kobber (I) klorid.
- CuClto: kobber (II) klorid.
- TiCl4: titan (IV) klorid eller titantetraklorid.
Imidlertid kan hydrogen og ikke-metalliske elementer - til og med halogener selv - også danne halogenider. I disse tilfellene er ikke valget av ikke-metall navngitt på slutten:
- PCl5: fosforpentaklorid.
- BF3: bortrifluorid.
- Ali3: aluminiumtriiodid.
- HBr: hydrogenbromid.
- HVIS7: jodheptafluorid.
Organisk
Uansett om det er RX eller ArX, er halogen kovalent bundet til et karbonatom. I disse tilfellene er halogener nevnt med navn, og resten av nomenklaturen avhenger av molekylstrukturen til R eller Ar..
For det enkleste organiske molekylet, metan (CH4Følgende derivater erholdes ved å erstatte Cl med Cl:
- CH3Cl: klormetan.
- CHtoClto: diklormetan.
- CHCl3: triklormetan (kloroform).
- CCl4: tetraklormetan (karbon (IV) klorid eller karbontetraklorid).
Her består R av et enkelt karbonatom. Så for andre alifatiske kjeder (lineære eller forgrenede) telles antallet karbon som det er knyttet til halogenet fra:
CH3CHtoCHtoF: 1-fluorpropan.
Eksemplet ovenfor var det for et primært alkylhalogenid. I tilfelle kjeden er forgrenet, velges den lengste kjeden som inneholder halogenet, og tellingen begynner og etterlater minst mulig antall:
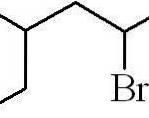
3-metyl-5-bromheksan
Det samme skjer for andre substituenter. På samme måte, for aromatiske halogenider, heter halogenet og deretter resten av strukturen:
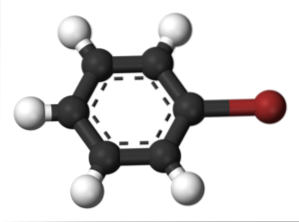
Det øvre bildet viser forbindelsen kalt brombenzen, og fremhever bromatomet i brunt.
Eiendommer
Uorganiske halogenider
Uorganiske halogenider er ioniske eller molekylære faste stoffer, selv om førstnevnte er rikeligere. Avhengig av interaksjoner og ioniske radier av MX, vil den være løselig i vann eller andre mindre polare løsemidler.
Ikke-metalliske halogenider (som borhalider) er generelt Lewis-syrer, noe som betyr at de aksepterer elektroner for å danne komplekser. På den annen side produserer hydrogenhalogenider (eller halogenider) oppløst i vann det som kalles hydrasider..
Dens smelte-, kokepunkt- eller sublimeringspunkter faller på de elektrostatiske eller kovalente interaksjonene mellom metallet eller ikke-metall med halogenet..
På samme måte spiller ioniske radier en viktig rolle i disse egenskapene. For eksempel hvis M+ og X- har lignende størrelser, vil krystallene dine være mer stabile.
Organiske halogenider
De er polare. Hvorfor? Fordi forskjellen i elektronegativiteter mellom C og halogen skaper et permanent polarmoment i molekylet. Likeledes synker dette når gruppe 17 kommer ned, fra CF-bindingen til C-I.
Uavhengig av den molekylære strukturen til R eller Ar, påvirker det økende antall halogener kokepunktene direkte, siden de øker molmassen og intermolekylære interaksjoner (RC-X-X-CR). De fleste er ikke blandbare med vann, men kan oppløses i organiske løsningsmidler.
applikasjoner
Bruken av halogenerte derivater kan reservere sin egen tekst. De molekylære "partnere" av halogener er en nøkkelfaktor, siden deres egenskaper og reaktiviteter definerer bruken av derivatet..
Følgende skiller seg ut blant det store mangfoldet av mulige bruksområder:
- Molekylære halogener brukes til å lage halogenpærer, der de kommer i kontakt med glødelampen. Hensikten med denne blandingen er å reagere halogen X med fordampet wolfram. På denne måten unngås avsetning på overflaten av pæren, noe som garanterer lengre levetid..
- Fluorsalter brukes i fluorering av vann og tannkremer.
- Natrium- og kalsiumhypokloritter er to aktive stoffer i kommersielle blekningsløsninger (klor)..
- Selv om de skader ozonlaget, brukes klorfluorkarboner (CFC) i aerosoler og kjølesystemer..
- Vinylklorid (CHto= CHCl) er monomeren av polyvinylklorid (PVC) polymer. På den annen side består Teflon, brukt som et non-stick materiale, av polymerkjeder av tetrafluoretylen (FtoC = CFto).
- De brukes i analytisk kjemi og i organiske synteser til forskjellige formål; blant disse, syntesen av medikamenter.
Ytterligere eksempler
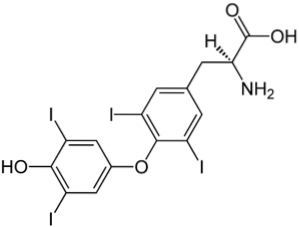
Det øvre bildet illustrerer skjoldbruskkjertelhormonet, som er ansvarlig for produksjonen av varme så vel som økningen av den generelle metabolismen i kroppen. Denne forbindelsen er et eksempel på et halogenert derivat tilstede i menneskekroppen.
Blant andre halogenerte forbindelser er følgende nevnt:
- Diklordifenyltrikloretan (DDT), effektivt insektmiddel, men med alvorlige miljøpåvirkninger.
- Tinnklorid (SnClto), brukt som reduksjonsmiddel.
- Kloroetan eller 1-kloretan (CH3CHtoCl), en lokalbedøvelse som virker raskt ved å kjøle ned huden.
- Dikloretylen (ClCH = CClH) og tetrakloretylen (CltoC = CClto), brukt som løsemidler i renseriindustrien.
Referanser
- Dr. Ian Hunt. Grunnleggende IUPAC organisk nomenklatur Haloalkaner / alkylhalogenider. Hentet 4. mai 2018 fra: chem.ucalgary.ca
- Richard C. Banks. (August 2000). Nomenklatur for organiske halider. Hentet 4. mai 2018 fra: chemistry.boisestate.edu
- Advameg, Inc. (2018). Organiske halogenforbindelser. Hentet 4. mai 2018 fra: chemistryexplained.com
- Organiske halogenforbindelser. Hentet 4. mai 2018 fra: 4college.co.uk
- Dr. Seham Alterary. (2014). Organiske halogenforbindelser. Hentet 4. mai 2018 fra: fac.ksu.edu.sa
- Clark J. Fysiske egenskaper til alkylhalogenider. Hentet 4. mai 2018 fra: chem.libretexts.org
- Dr. Manal K. Rasheed. Organiske halider. Hentet 4. mai 2018 fra: comed.uobaghdad.edu.iq



Ingen har kommentert denne artikkelen ennå.