
Dimetylamin ((CH3) 2NH) struktur, egenskaper, bruksområder, risiko

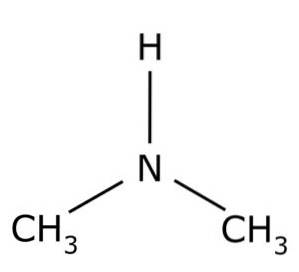
De dimetylamin er en organisk forbindelse dannet av to metylgrupper -CH3 knyttet til en -NH gruppe. Dens kjemiske formel er (CH3)toNH. Det er en fargeløs gass. Når det er i luften ved lave konsentrasjoner, oppfattes en fiskeaktig lukt. Imidlertid, hvis det er i høy konsentrasjon, har det lukten av ammoniakk NH3.
Dimetylamin er tilstede i planter og dyr. Det antas at det hos mennesker kommer fra nedbrytningen av visse enzymer, men også fra inntak av noen matvarer som fisk. Hvis dimetylamingass oppløses i vann, danner den svært alkaliske og etsende løsninger.
Den har forskjellige industrielle bruksområder som å produsere løsemidler, for å akselerere vulkanisering av gummi, for å hemme korrosjon av rør, for å lage såper, for å forberede fargestoffer og for å absorbere sure gasser i visse prosesser..
Dimetylamin er en meget brannfarlig gass. Beholdere skal ikke utsettes for varme eller ild da de kan eksplodere. I tillegg er dampene irriterende for øynene, huden og luftveiene..
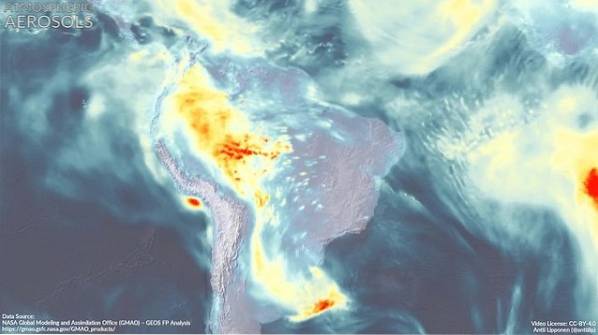
Det er en forbindelse som kan være en del av atmosfæriske aerosoler, det vil si veldig fine dråper som finnes i atmosfæren.
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Kokepunkt
- 3.5 Flammepunkt
- 3.6 Selvantennelsestemperatur
- 3.7 Tetthet
- 3.8 Løselighet
- 3,9 pH
- 3.10 Dissosiasjonskonstant
- 3.11 Kjemiske egenskaper
- 3.12 Andre egenskaper
- 3.13 Biokjemiske reaksjoner
- 4 Motta
- 5 Tilstedeværelse i naturen
- 5.1 Pasienter med overskudd av dimetylamin
- 6 bruksområder
- 7 Risiko
- 8 Innflytelse av DMA på atmosfæren
- 9 Referanser
Struktur
Dimetylamin er et sekundært alifatisk amin. Dette betyr at nitrogensubstituentene (N) er alifatiske (-CH3), som betyr at de ikke er aromatiske, og at de er to. Derfor er de to metyler -CH3 festet til nitrogen, som også har et hydrogen (H).
I dimetylaminmolekylet har nitrogen (N) et par frie elektroner, det vil si et par elektroner som ikke er bundet til noe annet atom..
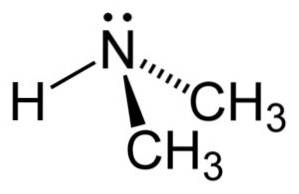
Nomenklatur
- Dimetylamin
- N, N-dimetylamin
- N-metylmetanamin
- DMA (akronym for di-metylamin).
Eiendommer
Fysisk tilstand
Fargeløs gass.
Molekylær vekt
45,08 g / mol
Smeltepunkt
-93 ºC
Kokepunkt
7,3 ºC
Flashpoint
-6,69 ºC (lukket koppmetode).
Selvantennelsestemperatur
400 ° C
Tetthet
Væske = 0,6804 g / cm3 ved 0 ºC.
Damp = 1,6 (relativ tetthet i forhold til luft, luft = 1).
Løselighet
Svært løselig i vann: 163 g / 100 g vann ved 40 ° C. Løselig i etanol og etyleter.
pH
Vandige dimetylaminløsninger er sterkt basiske.
Dissosiasjonskonstant
Kb = 5,4 x 10-4
pKtil konjugert syre = 10,732 ved 25 ° C. Den konjugerte syren er dimetylammoniumion: (CH3) NHto+
Kjemiske egenskaper
Flytende dimetylamin kan angripe plast, gummi og belegg.
Når det er oppløst i vann, tar nitrogens frie elektronpar (N) på seg et proton (H+) fra vannet, og etterlater en OH fri-, så det danner veldig alkaliske og etsende løsninger:
Dimetylamin + vann → Dimetylammoniumion + hydroksylion
(CH3)toNH + HtoO → (CH3)toNHto+ + Åh-
Med salpetersyre får du et nitratsalt, det vil si dimetylammoniumnitrat:
Dimetylamin + salpetersyre → dimetylammoniumnitrat
(CH3)toNH + HNO3 → (CH3)toNHto+IKKE3-
Andre egenskaper
Når den er i lav konsentrasjon i luften, har den en fiskeaktig lukt, mens den i høye konsentrasjoner lukter som ammoniakk (NH3).
Biokjemiske reaksjoner
I kroppen kan dimetylamin gjennomgå nitrosering under svakt sure forhold for å gi dimetylnitrosamin en kreftfremkallende forbindelse (CH3)toN-NO.
Dannelsen av dimetylnitrosamin oppstår fra dimetylamin og nitrit (natriumnitritt) i magen (ved pH 5-6) ved innvirkning av bakterier i mage-tarmkanalen. Natriumnitritt er tilstede i noen matvarer.
Dimetylamin + Sodium Nitrite → Dimethylnitrosamine + Sodium Hydroxide
(CH3)toNH + NaNOto → (CH3)toN-NO + NaOH
Å skaffe
Dimetylamin fremstilles kommersielt ved å omsette metanol (CH3OH) med ammoniakk (NH3ved 350-450 ° C i nærvær av en silika-aluminiumoksydkatalysator (SiOto/TiltoELLER3).
2 CH3OH + NH3 → (CH3)toNH + 2 HtoELLER
Siden monometylamin og trimetylamin også produseres, utføres rensing i en serie på fire til fem destillasjonskolonner..
Tilstedeværelse i naturen
Dimetylamin finnes i planter og dyr. Det finnes også naturlig og rikelig i menneskelig urin.
Det anslås at dets tilstedeværelse hos mennesker skyldes at den produseres av visse typer tarmbakterier fra noen forbindelser som finnes i mat..
Noen av disse forbindelsene er kolin (en forbindelse som er forbundet med gruppen B-vitaminer) og trimetylaminoksyd. Det antas også å komme fra et enzym som hemmer nitrogenoksid (NO) som dannes i kroppen..
Visse informasjonskilder indikerer at økningen i dimetylamin i urinen er forårsaket av inntak av fisk og sjømat, hvor de høyeste verdiene oppnås når blekksprut, kulmule, sardiner, sverdfisk, torsk, hvilling og stråle spises..

Pasienter med overflødig dimetylamin
Dimetylamin anses å være et uremisk gift, det vil si et stoff som kan forårsake skade hvis konsentrasjonen i urinen er for høy. Faktisk er det blitt observert veldig høye nivåer av dimetylamin hos pasienter med nyresykdom i sluttstadiet..
Det antas at det hos disse pasientene kan være en overbefolkning av tarmbakterier som kan produsere den.
applikasjoner
Dimetylamin eller DMA brukes til å:
- Fremstilling av andre forbindelser.
- Produksjon av løsningsmidlene dimetylformamid og dimetylacetamid.
- Akselerere vulkaniseringen av visse gummier.
- Fjern håret fra hudene under soling.
- Handle som en antioksidant for løsemidler.
- Serveres som et mineralflytemiddel.
- Hemme korrosjon og som et antifoulingmiddel for rør.
- Fungere som et overflateaktivt middel.
- Lag såper og vaskemidler.
- Fungere som tekstilkjemiker.
- Fungerer som et antiknokkemiddel i drivstoff og som en stabilisator for bensin.
- Forbered fargestoffer.
- Absorber syre gasser.
- Serveres som drivmiddel for plantevernmidler og raketter.
- Vær en del av midler for vannbehandling.
- Fungere som et soppdrepende middel i landbrukskjemiske produkter.
- Utgåtte bruksområder som å tiltrekke og drepe snegler eller insekter som angriper bomull.


Risiko
Dimetylamindamp irriterer huden, øynene og luftveiene..
Hvis den kommer i kontakt med huden i flytende form, kan det forårsake forfrysninger og kjemiske forbrenninger. Innåndingen har skadelige helseeffekter.
DMA-gass er etsende og kan danne etsende vandige løsninger. De vandige løsningene kan bli brannfarlige med mindre de er fortynnet godt..
Dimetylamin i gassform antennes lett og produserer giftige røyk av nitrogenoksider (NOx).
Hvis beholderen som inneholder denne gassen utsettes for brann eller intens varme, kan den eksplodere..
Påvirkning av DMA på atmosfæren
Den atmosfæriske aerosolen (veldig små dråper av blandinger av naturlige forbindelser og / eller forurensende stoffer i atmosfæren) har en dyp innvirkning på det globale klimaet og på luftkvaliteten i de forskjellige regionene i verden..
Dannelsen av de nye aerosolpartiklene er ennå ikke helt forstått.
Det anslås at dimetylamin deltar sammen med andre forbindelser i dannelsen av disse partiklene, noe som ser ut til å avhenge av at det er sterke utslipp av DMA i området..
For eksempel er det i industriområder en høyere konsentrasjon enn i jordbruksområder, og dette kan påvirke måten WFD deltar på..
Det er bemerkelsesverdig at forbrenning av plantemateriale som inneholder glyfosat (et av de mest brukte herbicidene i verden), ifølge noen forskere, kan føre til dannelse av dimetylamin.
Referanser
- OSS. National Library of Medicine. (2019). Dimetylamin. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fjerde utgave. John Wiley & Sons.
- Morrison, R.T. og Boyd, R.N. (2002). Organisk kjemi. 6. utgave. Prentice-Hall.
- Windholz, M. et al. (redaktører) (1983). Merck-indeksen. En leksikon med kjemikalier, medisiner og biologiske stoffer. Tiende utgave. Merck & CO., Inc..
- Abramowitz, M.K. et al. (2010). Patofysiologien til uremi. Alifatiske aminer. I kronisk nyresykdom, dialyse og transplantasjon (tredje utgave). Gjenopprettet fra sciencedirect.com.
- Li, H. et al. (2019). Påvirkning av atmosfæriske forhold på svovelsyre-dimetylamin-ammoniakkbasert nypartikkeldannelse. Kjemosfære 2019; 245: 125554. Gjenopprettet fra ncbi.nlm.nih.gov.
- Mackie, J.C. og Kennedy, E.M. (2019). Pyrolyse av glyfosat og dets giftige produkter. Miljø. Sci. Technol. 2019: 53 (23): 13742-13747. Gjenopprettet fra ncbi.nlm.nih.gov.



Ingen har kommentert denne artikkelen ennå.