
Polære kovalente bindingsegenskaper og eksempler

EN polar kovalent binding Det er den som er dannet mellom to kjemiske elementer hvis elektronegativitetsforskjell er betydelig, men uten å nærme seg en rent ionisk karakter. Det er derfor et sterkt mellomliggende samspill mellom de apolare kovalente bindingene og de ioniske bindingene..
Det sies å være kovalent fordi det i teorien er en likeverdig deling av et elektronisk par mellom de to bundet atomene; det vil si at de to elektronene deles likt. Atomet E donerer et elektron, mens X bidrar med det andre elektronet til å danne den kovalente bindingen E: X eller E-X.
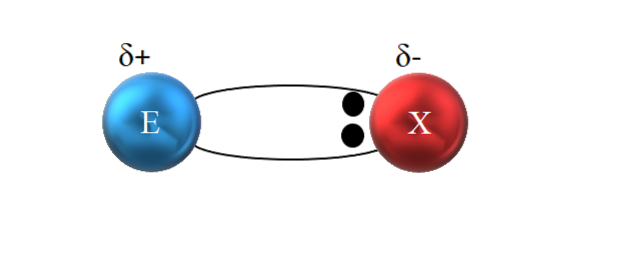
Imidlertid, som vist på bildet ovenfor, er de to elektronene ikke plassert i midten av E og X, noe som indikerer at de "sirkulerer" med samme frekvens mellom begge atomene; snarere er de nærmere X enn E. Dette betyr at X har tiltrukket elektronparet mot seg selv på grunn av sin høyere elektronegativitet.
Ettersom elektronene til bindingen er nærmere X enn E, dannes rundt X et område med høy elektrondensitet, δ-; mens i E vises et elektronfattig område, δ +. Derfor er det en polarisering av elektriske ladninger: en polær kovalent binding.
Artikkelindeks
- 1 Funksjoner
- 1.1 Grad av polaritet
- 1.2 Kjemiske grunnstoffer som stammer fra dem
- 1.3 Polar og ionisk karakter
- 2 Eksempler på polær kovalent binding
- 2.1 C-O
- 2.2 H-X
- 2.3 O-H
- 2,4 N-H
- 2,5 Fe-O
- 3 Referanser
Kjennetegn
Grad av polaritet
Kovalente bindinger er veldig rikelig i naturen. De er tilstede i praktisk talt alle heterogene molekyler og kjemiske forbindelser; siden den til slutt dannes når to forskjellige atomer E og X binder seg. Imidlertid er det kovalente bindinger som er mer polare enn andre, og for å finne ut av det, må man ty til elektronegativiteter.
Jo mer elektronegativ X er, og jo mindre elektronegativ E er (elektropositiv), vil den resulterende kovalente bindingen være mer polær. Den konvensjonelle måten å estimere denne polariteten på er gjennom formelen:
χX - χOG
Hvor χ er elektronegativiteten til hvert atom i henhold til Pauling-skalaen.
Hvis denne subtraksjonen eller subtraksjonen har verdier mellom 0,5 og 2, vil det være en polarbinding. Derfor er det mulig å sammenligne polaritetsgraden mellom forskjellige E-X lenker. Hvis den oppnådde verdien er høyere enn 2, snakker vi om en ionebinding, E.+X- Og det er det ikkeδ+-Xδ-.
Polariteten til E-X-bindingen er imidlertid ikke absolutt, men avhenger av de molekylære omgivelsene; det vil si i et molekyl -E-X-, der E og X danner kovalente bindinger med andre atomer, har sistnevnte direkte innflytelse på nevnte grad av polaritet.
Kjemiske elementer som stammer fra dem
Selv om E og X kan være hvilket som helst element, forårsaker ikke alle polare kovalente bindinger. For eksempel, hvis E er et meget elektropositivt metall, slik som de alkaliske (Li, Na, K, Rb og Cs), og X er et halogen (F, Cl, Br og I), vil de ha en tendens til å danne ioniske forbindelser (Na+Cl-) og ingen molekyler (Na-Cl).
Det er derfor polare kovalente bindinger vanligvis finnes mellom to ikke-metalliske elementer; og i mindre grad mellom ikke-metalliske elementer og noen overgangsmetaller. Ser på blokken s i det periodiske systemet har du mange muligheter for å danne disse typer kjemiske bindinger.
Polar og ionisk karakter
I store molekyler er det ikke veldig viktig å tenke på hvor polar en binding er; Disse er svært kovalente, og fordelingen av deres elektriske ladninger (der de elektronrike eller fattige regionene er) trekker mer oppmerksomhet enn å definere graden av kovalens av deres indre bindinger..
Imidlertid, med diatomiske eller små molekyler, sa polariteten Eδ+-Xδ- det er ganske relativt.
Dette er ikke et problem med molekyler dannet mellom ikke-metalliske elementer; Men når overgangsmetaller eller metalloider deltar, snakker vi ikke lenger bare om en polær kovalent binding, men om en kovalent binding med en viss ionisk karakter; og når det gjelder overgangsmetaller, med en kovalent koordineringsbinding gitt sin natur.
Eksempler på polær kovalent binding
CO
Den kovalente bindingen mellom karbon og oksygen er polær, fordi førstnevnte er mindre elektronegativ (χC = 2,55) enn det andre (χELLER = 3,44). Derfor, når vi ser C-O, C = O eller C-O obligasjoner-, vi vil vite at de er polare bindinger.
H-X
Hydrogenhalogenider, HX, er ideelle eksempler for å forstå polarbinding i diatomiske molekyler. Har elektronegativiteten til hydrogen (χH = 2.2), kan vi estimere hvor polære disse halogenidene er for hverandre:
-HF (H-F), χF (3.98) - χH (2.2) = 1,78
-HCl (H-Cl), χCl (3.16) - χH (2.2) = 0.96
-HBr (H-Br), χBr (2.96) - χH (2.2) = 0.76
-HI (H-I), χJeg (2.66) - χH (2.2) = 0.46
Merk at ifølge disse beregningene er HF-bindingen den mest polare av alle. Nå, hva er dets ioniske karakter uttrykt i prosent, er en annen sak. Dette resultatet er ikke overraskende fordi fluor er det mest elektronegative elementet av alle..
Ettersom elektronegativiteten faller fra klor til jod, blir H-Cl, H-Br og H-I bindinger også mindre polare. H-I-bindingen skal være apolar, men den er faktisk polær og også veldig "sprø"; bryter lett.
ÅH
O-H polarbindingen er kanskje den viktigste av alt: takket være det eksisterer livet, siden det samarbeider med dipolmomentet til vann. Hvis vi estimerer forskjellen mellom elektronegativitetene til oksygen og hydrogener, vil vi ha:
χELLER (3.44) - χH (2.2) = 1.24
Vannmolekylet, HtoEller du har to av disse bindingene, H-O-H. Dette, og molekylets vinkelgeometri og dets asymmetri, gjør det til en svært polær forbindelse..
N-H
NH-bindingen er til stede i aminogruppene i proteiner. Gjenta samme beregning som vi har:
χN (3.04) - χH (2.2) = 0.84
Dette gjenspeiler at N-H-bindingen er mindre polær enn O-H (1,24) og F-H (1,78).
Stygg
Fe-O-bindingen er viktig fordi oksidene finnes i jernmineraler. La oss se om det er mer polar enn H-O:
χELLER (3.44) - χTro (1,83) = 1,61
Derfor antas det med rette at Fe-O-bindingen er mer polær enn H-O (1,24) -bindingen; eller hva er det samme som å si: Fe-O har større ionisk karakter enn H-O.
Disse beregningene brukes til å finne ut gradene av polaritet mellom forskjellige lenker; men de er ikke nok til å bestemme om en forbindelse er ionisk, kovalent eller dens ioniske karakter.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Laura Nappi. (2019). Polare og ikke-polære kovalente obligasjoner: definisjoner og eksempler. Studere. Gjenopprettet fra: study.com
- Helmenstine, Anne Marie, Ph.D. (18. september 2019). Polar Bond Definisjon og eksempler (Polar Covalent Bond). Gjenopprettet fra: thoughtco.com
- Elsevier B.V. (2019). Polar kovalent binding. ScienceDirect. Gjenopprettet fra: sciencedirect.com
- Wikipedia. (2019). Kjemisk polaritet. Gjenopprettet fra: en.wikipedia.org
- Anonym. (5. juni 2019). Egenskaper for polare kovalente obligasjoner. Kjemi LibreTexts. Gjenopprettet fra: chem.libretexts.org



Ingen har kommentert denne artikkelen ennå.