
Sigma Link Hvordan det dannes, kjennetegn og eksempler
De sigma link (representert som σ) er en kovalent type forening, som er preget av delingen av to elektroner som oppstår mellom et par atomer for å danne nevnte binding. I tillegg er dette en slags enkeltbinding, der begge atomene er festet av to elektroner for å danne en enkeltbinding..
Når to eller flere atomer kombineres for å gi opphav til nye molekylære forbindelser, blir de forbundet ved hjelp av to typer bindinger: ionisk og kovalent, hvis struktur avhenger av hvordan elektronene deles mellom begge atomene som er involvert i denne koblingen..
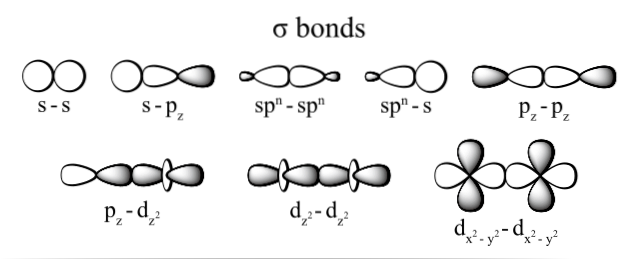
Forbindelsen generert gjennom elektronene utføres takket være overlappingen av orbitalene som hører til hvert atom (ved endene), og forstå som orbitaler rom hvor det er mest sannsynlig å lokalisere elektronet i atomet og som er definert av elektron tetthet.
Artikkelindeks
- 1 Hvordan dannes det?
- 1.1 Dannelse av sigma-bindinger i forskjellige kjemiske arter
- 2 funksjoner
- 3 eksempler
- 4 Referanser
Hvordan er det dannet?
Vanligvis er enkeltbindingen mellom to atomer kjent for å være ekvivalent med en enkelt sigma-binding..
På samme måte stammer disse bindingene på grunn av superposisjon eller overlapping på en frontal måte som oppstår mellom endene av atomorbitalene til to forskjellige atomer..
Disse atomer hvis orbitaler overlapper hverandre må ligge ved siden av hverandre slik at de individuelle elektronene som hører til hver atombane, effektivt kan binde og danne bindingen..
Derav det faktum at den elektroniske fordelingen som manifesterer seg eller plasseringen av tettheten til elektronene fra hver superposisjon har en sylindrisk symmetri rundt aksen som oppstår mellom de to sammenkoblede atomartene..
I dette tilfellet kan den såkalte sigma-orbitalen lettere uttrykkes i form av intramolekylære bindinger som dannes i diatomiske molekyler, og bemerker at det også er flere typer sigma-bindinger..
De mest observerte typene sigma-binding er: dzto+dzto, s + sz, sz+sz og s + s; hvor tegnet z representerer aksen som dannes av bindingen som dannes, og hver bokstav (s, p og d) tilsvarer en bane.
Dannelse av sigma-bindinger i forskjellige kjemiske arter
Når vi snakker om molekylære orbitaler, henvises det til regionene som akkumulerer den høyeste elektrontettheten når en binding av denne typen dannes mellom forskjellige molekyler, og oppnås gjennom kombinasjonen av atomorbitaler..
Fra kvantemekanikkens synspunkt har studier antatt at orbitaler av molekylær type som viser symmetrisk lik oppførsel faktisk kombineres i blandinger (hybridiseringer).
Imidlertid er betydningen av denne kombinasjonen av orbitaler nært knyttet til de relative energiene manifestert av molekylære orbitaler som er symmetrisk like..
Når det gjelder organiske molekyler, blir sykliske arter bestående av en eller flere ringstrukturer ofte observert, som ofte utgjøres av et stort antall sigma-type bindinger i forbindelse med pi-type bindinger (multiple bindinger)..
Ved å bruke enkle matematiske beregninger er det faktisk mulig å bestemme antall sigma-bindinger tilstede i en molekylart..
Det er også tilfeller av koordineringsforbindelser (med overgangsmetaller), hvor flere bindinger kombineres med forskjellige klasser av bindingsinteraksjoner, samt molekyler som består av forskjellige typer atomer (polyatomiske).
Kjennetegn
Sigma-bindinger har unike egenskaper som tydelig skiller dem fra andre typer kovalent binding (pi-binding), blant annet er det faktum at denne typen binding er den sterkeste blant de kovalente klassen kjemiske bindinger.
Dette er fordi overlappingen mellom orbitalene skjer direkte, koaksialt (eller lineært) og frontalt; det vil si en maksimal overlapping oppnås mellom orbitalene.
I tillegg er den elektroniske fordelingen i disse kryssene hovedsakelig konsentrert mellom kjernene til atomartene som kombineres..
Denne overlappingen av sigma-orbitaler skjer på tre mulige måter: mellom et par rene orbitaler (s-s), mellom en ren bane og en hybrid-type (s-sp), eller mellom et par av hybrid-orbitaler (sp3- sp3).
Hybridisering skjer takket være blandingen av orbitaler av atomisk opprinnelse i forskjellige klasser, og oppnår at den resulterende hybridbunnen avhenger av mengden av hver av typene rene startorbitaler (for eksempel sp3 = en ren s orbital + tre rene orbitaler av p-typen).
I tillegg til dette kan sigma-bindingen eksistere uavhengig, samt innrømme fri rotasjonsbevegelse mellom et par atomer..
Eksempler
Siden den kovalente bindingen er den vanligste typen binding mellom atomer, er sigma-bindingen funnet i et stort antall kjemiske arter, som det kan sees nedenfor.
I diatomiske gassmolekyler - slik som hydrogen (Hto), oksygen (Oto) og nitrogen (Nto) - forskjellige typer bindinger kan forekomme avhengig av hybridiseringen av atomene.
Når det gjelder hydrogen, er det en enkelt sigma-binding som forbinder begge atomene (H-H), fordi hvert atom bidrar med sitt eneste elektron.
På den annen side, i molekylært oksygen er begge atomene bundet av en dobbeltbinding (O = O) - det vil si en sigma-binding - og en pi-binding, og etterlater hvert atom sitt med tre par gjenværende elektroner paret.
I stedet har hvert nitrogenatom fem elektroner i sitt ytterste energinivå (valensskall), så de er forbundet med en trippelbinding (N≡N), noe som innebærer tilstedeværelse av en sigma-binding og to pi-bindinger og et par sammenkoblede elektroner i hvert atom.
På samme måte forekommer det i forbindelser av syklisk type med enkelt- eller multiple bindinger og i alle slags molekyler hvis struktur består av kovalente bindinger..
Referanser
- Wikipedia. (s.f.). Sigma bond. Gjenopprettet fra en.wikipedia.org
- Chang, R. (2007). Kjemi, niende utgave. Mexico: McGraw-Hill.
- ThoughtCo. (s.f.). Definisjon av Sigma Bond Chemistry. Gjenopprettet fra thoughtco.com
- Britannica, E. (s.f.). Sigma bond. Hentet fra britannica.com
- LibreTexts. (s.f.). Sigma og Pi obligasjoner. Gjenopprettet fra chem.libretexts.org
- Srivastava, A. K. (2008). Organisk kjemi gjort enkelt. Gjenopprettet fra books.google.co.ve



Ingen har kommentert denne artikkelen ennå.