
Pauling skalerer elektronegativitet og energiforskjell

De Pauling skala er en vilkårlig skala som brukes i kjemi for å uttrykke elektronegativitet av elementene. Dette er definert som tendensen til et bestemt atom til å tiltrekke seg elektroner når det kombineres med et annet atom.
I denne forstand, har elementer med høy elektronegativitet en tendens til å få elektroner lett. Dette er ikke-metaller, mens det for deres del er mindre elektronegative elementer som metaller, det er lettere å gi opp elektroner.
Derfor, når man kjenner elektronegativiteten til et element, har man en ide om hvilken type binding det er i stand til å danne når det kombineres med et annet. Vi vil se dette med et numerisk eksempel senere..
Med denne informasjonen kan mange av egenskapene som en forbindelse vil ha forutsies, noe som er veldig nyttig i eksperimentell kjemi og for materialvitenskap, der nye forbindelser kontinuerlig blir opprettet..
Det er imidlertid praktisk å avklare at til tross for hvor viktig det er, er det ingen eneste måte å bestemme elektronegativitet på; Pauling-skalaen er bare en av de forskjellige måtene som foreslås for å finne den, selv om den er en av de mest brukte.
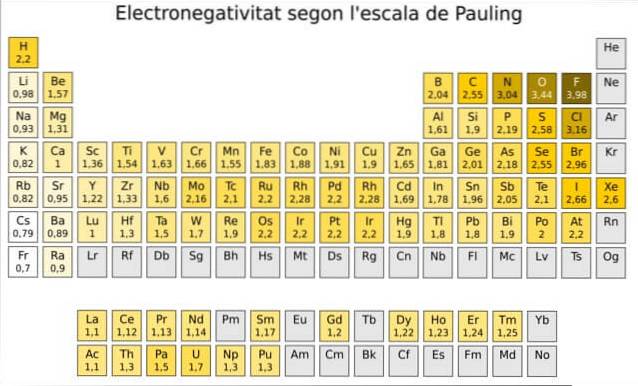
Faktisk er Paulings en vilkårlig skala der en numerisk verdi tildeles hvert element i det periodiske systemet, som gjenspeiler dets elektronegativitet. Vi ser det i figur 1, hvor vi har elektronegativiteten til hvert element, som tildelt av den to-gangs nobelpristageren Linus Pauling (1901-1994) rundt 1939.
Artikkelindeks
- 1 Elektronegativiteten til elementene
- 1.1 Elektronegativitet i det periodiske systemet
- 2 Bindende energiforskjell
- 2.1 Ligninger for elektronegativitet
- 3 Eksempel
- 3.1 Løsning
- 4 Referanser
Elementers elektronegativitet
Pauling, sammen med Don M. Yost, fant elektronegativitetsverdiene empirisk, gjennom eksperimentelle data oppnådd ved å måle bindingsenergier..
Pauling tildelte elementet fluor - over og til høyre for tabellen i figur 1 - den høyeste elektronegativiteten, med tallet 4.0. Så når fluor danner bindinger, viser det den høyeste tendensen til å tiltrekke seg elektroner av alle grunnstoffer..
For det andre er oksygen med 3,5 og tredje er nitrogen med 3,0. Begge er plassert øverst og til høyre for bordet.
På den annen side, motsatt ekstrem, er det minst elektronegative elementet cesium, hvis symbol er Cs, plassert til venstre for bordet, som Pauling tildelte tallet 0,7.
Elektronegativitet i det periodiske systemet
Generelt, og som det fremgår av figur 1, øker elektronegativitet - og ioniseringsenergi - fra venstre til høyre i det periodiske systemet. Den generelle trenden indikerer også en nedgang når du beveger deg fra topp til bunn.
Derfor vil vi ha de mest elektronegative elementene øverst til høyre i tabellen: fluor, oksygen, klor, nitrogen. Den minste elektronegative - eller den mest elektropositive hvis du foretrekker det - finner du til venstre: litium, natrium, kalium og de andre elementene i gruppe 1 - kolonnen ytterst til venstre, tilsvarende jord- og jordalkalimetallene.-.
I hver kolonne avtar elektronegativiteten når atomnummeret til elementet øker, bortsett fra overgangsmetallene i sentrum, som ikke følger denne trenden..
Et viktig poeng å merke seg er at elektronegativitet er relativ, det er ikke en uforanderlig egenskap for hvert element, og det måles bare i forhold til det til andre elementer. Det avhenger mye av oksidasjonstilstanden, så det samme elementet kan utvise forskjellig elektronegativitet, avhengig av hvilken type forbindelse det danner..
Bindende energiforskjell

I kjemi er en binding måten atomer, de samme eller forskjellige, går sammen for å danne molekyler. Mellom atomene vises krefter som holder dem sammen på en stabil måte.
Det er flere typer lenker, men her blir to vurdert:
-Kovalent, der atomer med lignende elektronegativiteter deler et par elektroner.
-Jonisk, hyppig mellom atomer med forskjellige elektronegativiteter der elektrostatisk tiltrekning hersker.
Anta at to grunnstoffer A og B kan danne molekyler med hverandre, betegnet AA og BB. Og at de også er i stand til å bli sammen for å danne en AB-forbindelse, gjennom noen form for binding.
Takket være deltakelsen av intermolekylære krefter er det energi i båndet. For eksempel er energien i binding AA EAA, i obligasjon BB er det EBB og til slutt i forbindelse AB er det E.AB.
Hvis molekylet AB ble dannet av en kovalent binding, er teoretisk bindingsenergien gjennomsnittet av energiene E.AA og EBB:
OGAB = ½ (EAA + OGBB)
Pauling beregnet EAB for forskjellige forbindelser, målte han det eksperimentelt og bestemte forskjellen mellom begge verdiene, som han kalte Δ:
Δ = | (EAB) målt - (EAB) teoretisk | = | (EAB) målt - ½ (EAA + OGBB) |
Pauling resonnerte slik: hvis Δ er veldig nær 0, betyr det at elektronegativitetene til begge elementene er like, og bindingen som forbinder dem er kovalent. Men hvis Δ ikke er liten, er ikke bindingen mellom A og B ren kovalent.
Jo større den absolutte verdien av Δ, jo større er forskjellen mellom elektronegativiteten til elementene A og B, og derfor vil bindingen som forbinder dem være av ionetypen. Senere vil leseren finne et eksempel der det ved å beregne Δ er mulig å bestemme typen av binding til en forbindelse.
Ligninger for elektronegativitet
Forutsatt at forskjellen i energier er signalet som skiller båndets natur, utførte Pauling mange eksperimenter som førte ham til å skape et empirisk uttrykk for de relative elektronegativitetene til to element A og B som danner et molekyl..
Pauling, som betegner denne elektronegativiteten som χ (gresk bokstav “chi”), definerte Δ som følger:
Fto· Δ = [χ (A) - χ (B)]to
χ (A) - χ (B) = f√Δ = 0,102√Δ
Merk at Δ er en positiv mengde. Faktoren f = 0,102 som vises ved å multiplisere kvadratroten til Δ er konverteringsfaktoren mellom kJ (kilojoules) og eV (elektronvolt), begge enheter av energi.
Hvis i stedet kilokalorier og elektronvolter brukes, uttrykkes forskjellen i elektronegativiteter med en lignende formel, men med f = 0,208:
χ (A) - χ (B) = 0,208√Δ
Pauling begynte med å tilordne hydrogen en verdi på 2,1, en tidligere verdi oppnådd av kjemiker Robert Mulliken. Han valgte dette elementet som utgangspunkt fordi det danner kovalente bindinger med mange andre..
Ved hjelp av ovenstående ligning fortsatte han med å tilordne relative verdier til resten av elementene. Han innså dermed at elektronegativiteten øker når man beveger seg fra venstre til høyre og fra topp til bunn i det periodiske systemet, som beskrevet i forrige avsnitt..
Eksempel
Nedenfor er en liste over elementer: N, J, Y og M og deres respektive elektronegativiteter Χ i henhold til Pauling-skalaen:
-N: Χ = 4.0
-J: Χ = 1,5
-Y: Χ = 0,9
-M: Χ = 1.6
Blant følgende forbindelser dannet med dem:
YJ, YN, MN og JM
Angi den med den høyeste ioniske karakteren og den som har kovalent natur. Årsaken til svaret ditt.
Løsning
I henhold til kriteriene etablert av Pauling, vil forbindelsen med størst ionisk karakter være den med størst forskjell mellom elektronegativiteter, og derfor en større verdi av Δ. For sin del er forbindelsen med den minste energiforskjellen den med en kovalent binding.
Deretter beregner vi hvor mye Δ er verdt for hver forbindelse, som følger:
Kompositt YJ
Δ = [χ (Y) - χ (J)]to = (0,9 - 1,5)to = 0,36
Kompositt YN
Δ = [χ (Y) - χ (N)]to = (0,9 - 4,0)to = 9,61
Kompositt MN
Δ = [χ (M) - χ (N)]to = (1,6 - 4,0)to = 5,76
Kompositt JM
Δ = [χ (J) - χ (M)]to = (1,5 - 1,6)to = 0,01
Fra de forrige resultatene følger det at den ioniske forbindelsen er YN, hvis Δ = 9,61, mens den kovalente forbindelsen er JM, med Δ = 0,01.
Referanser
- Kjemi Libretexts. Pauling elektronegativitet. Gjenopprettet fra: chem.libretexts.org.
- IUPAC gullbok. Elektronegativitet. Gjenopprettet fra: goldbook.iupac.org.
- Salas-Banuet, G. Den misforståtte elektronegativiteten. Gjenopprettet fra: scielo.org.
- Vitenskapelige tekster. Elektronegativitet. Gjenopprettet fra: textscientificos.com.
- Whitten, K. 2010. Kjemi. 9. plass. Ed. Brooks / Cole. Cengage læring.
- Wikipedia. Kovalent binding. Gjenopprettet fra: es.wikipedia.org.
- Wikipedia. Jonisk binding. Gjenopprettet fra: es.wikipedia.org.



Ingen har kommentert denne artikkelen ennå.