
Mikroskopiske skalaegenskaper, tellende partikler, eksempler
De mikroskopisk skala Det er en som brukes til å måle størrelser og lengder som ikke kan sees med det blotte øye, og som er under en millimeter i lengde. Fra høyeste til laveste er de mikroskopiske skalaene i det metriske systemet:
- Millimeter (1 mm), som er en tidel av en centimeter eller en tusendel av en meter. I dette er skalaen vi har en av de største cellene i kroppen, som er egget, hvis størrelse er 1,5 mm.
- Tiendedelen av en millimeter (0,1 mm). Dette er skalaen på tykkelsen eller diameteren på et menneskehår.
- Mikrometeret eller mikronen (1μm = 0,001mm). På denne skalaen er plante- og dyreceller og bakterier.
Planteceller er i størrelsesorden 100μm. Dyreceller er ti ganger mindre, det er i størrelsesorden 10μm; mens bakterier er 10 ganger mindre enn dyreceller og er i størrelsesorden 1μm.
Artikkelindeks
- 1 Nanoskala
- 2 instrumenter for mikroskopisk observasjon
- 3 Mikroskopiske egenskaper
- 3.1-Matter er et enormt tomrom
- 4 Hvordan telle partikler i mikroskopisk skala?
- 4.1-Eksempel 1
- 4.2-Eksempel 2
- 5 Referanser
Nano skala
Det er målinger som er enda mindre enn den mikroskopiske skalaen, men de brukes ikke ofte bortsett fra i noen spesielle sammenhenger. Her er noen av de viktigste nanometriske målingene:
- Nanometeret (1 ηm = 0,001 μm = 0,000001 mm) er en milliontedel av en millimeter. På denne skalaen er det noen virus og molekyler. Virus er i størrelsesorden 10ηm og molekyler i størrelsesorden 1ηm.
- Angstrømmen (1Å = 0,1ηm = 0,0001μm = 10-7mm). Denne målingen danner skalaen eller atomstørrelsen.
- Fantomometeret (1fm = 0,00001Å = 0,000001ηm = 10-12mm). Dette er skalaen til atomkjerner, som er mellom 10.000 og 100.000 ganger mindre enn atomet. Til tross for den lille størrelsen, konsentrerer kjernen seg imidlertid 99,99% av atommassen.
- Det er mindre skalaer til atomkjernen, siden disse består av partikler som protoner og nøytroner. Men det er mer: disse partiklene består i sin tur av mer grunnleggende partikler som kvarker..
Instrumenter for mikroskopisk observasjon
Når gjenstander er mellom millimeter- og mikrometervekten (1 mm - 0,001 mm), kan de observeres med et optisk mikroskop.
Imidlertid, hvis gjenstandene eller strukturene er mellom nanometer og Ångstrøm, vil elektronmikroskop eller nanoskop være nødvendig..
I elektronmikroskopi brukes i stedet for lys høyenergielektroner som har mye kortere bølgelengde enn lys. Ulempen med elektronmikroskopet er at det ikke er mulig å plassere levende prøver i det fordi det fungerer under vakuum..
I stedet bruker nanoskopet laserlys, og det har fordelen i forhold til elektronmikroskopi at strukturene og molekylene i en levende celle kan sees på og registreres..
Nanoteknologi er teknologien som kretser, konstruksjoner, deler og til og med motorer produseres på skalaer som går fra nanometeret til atomskalaen..
Mikroskopiske egenskaper
I fysikk studeres i en første tilnærming oppførselen til materie og systemer fra det makroskopiske synspunktet. Fra dette paradigmet er materie et uendelig delbart kontinuum; og dette synspunktet er gyldig og passer i mange situasjoner i hverdagen.
Noen fenomener i den makroskopiske verden kan imidlertid bare forklares hvis man tar hensyn til materiens mikroskopiske egenskaper..
På det mikroskopiske synspunktet tas det hensyn til stoffets molekylære og atomstruktur. I motsetning til den makroskopiske tilnærmingen, er det på denne skalaen en granulær struktur med hull og mellomrom mellom molekyler, atomer og til og med i dem..
Det andre kjennetegnet fra det mikroskopiske synspunktet i fysikken er at et stykke materie, uansett hvor lite, består av et enormt antall partikler atskilt fra hverandre og i kontinuerlig bevegelse..
-Saken er et enormt tomrom
I et lite stykke materiale er avstanden mellom atomene enorm sammenlignet med størrelsen, men i sin tur er atomene enorme sammenlignet med deres egne kjerner, hvor 99,99% av massen er konsentrert..
Det vil si at et stykke materiale på mikroskopisk skala er et enormt vakuum med konsentrasjoner av atomer og kjerner som opptar en liten brøkdel av det totale volumet. Slik sett ligner den mikroskopiske skalaen den astronomiske skalaen..
Fra makroskopiske gjenstander til oppdagelsen av atomet
De første kjemikerne, som var alkymistene, innså at materialene kunne være av to typer: ren eller sammensatt. Dermed kom ideen om kjemiske grunnstoffer frem.
De første kjemiske elementene som ble oppdaget var de syv metaller fra antikken: sølv, gull, jern, bly, tinn, kobber og kvikksølv. Over tid ble mer oppdaget i den grad det ble funnet stoffer som ikke kunne spaltes til andre.
Da ble elementene klassifisert i henhold til deres egenskaper og egenskaper i metaller og ikke-metaller. Alle de som hadde lignende egenskaper og kjemisk affinitet ble gruppert i samme kolonne, og dermed oppstod det periodiske systemet..
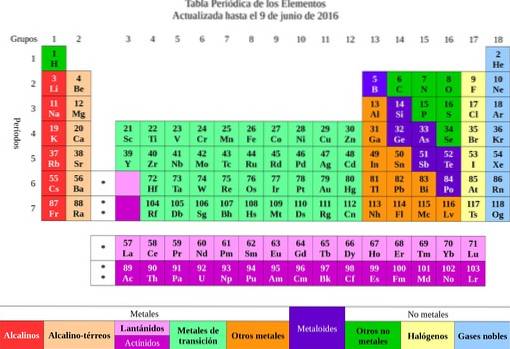
Fra elementene ble ideen om atomer overført, et ord som betyr udelelig. Kort tid senere innså forskere at atomer hadde en struktur. I tillegg hadde atomene to typer elektrisk ladning (positiv og negativ).
Subatomære partikler
I Rutherfords eksperimenter der han bombet atomene på en tynn gullplate med alfapartikler, ble atomets struktur avslørt: en liten positiv kjerne omgitt av elektroner.
Atomer fortsatte å bli bombardert med flere og flere energipartikler og gjøres fortsatt for å løse hemmelighetene og egenskapene til den mikroskopiske verden i mindre og mindre skala..
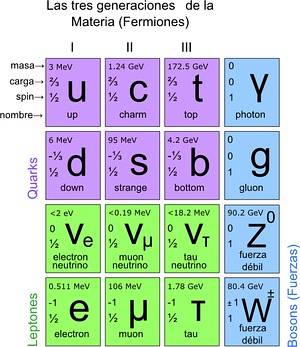
På denne måten ble standardmodellen nådd, der det er fastslått at de sanne elementære partiklene er de som atomene består av. Atomer gir i sin tur grunnstoffer, disse til forbindelser og alle kjente interaksjoner (unntatt gravitasjon). Totalt er det 12 partikler.
Disse grunnleggende partiklene har også sitt periodiske system. Det er to grupper: ½-spinn fermioniske partikler og bosoniske. Bosonene er ansvarlige for samspillet. Fermionikkene er 12 og er de som gir opphav til protoner, nøytroner og atomer.
Hvordan telle partikler i mikroskopisk skala?
Over tid oppdaget kjemikere de relative massene av elementene fra nøyaktige målinger i kjemiske reaksjoner. Dermed kan det for eksempel bestemmes at karbon er 12 ganger tyngre enn hydrogen..
Hydrogen ble også bestemt for å være det letteste elementet, så dette elementet ble tildelt den relative massen 1.
På den annen side krevde kjemikere å vite antall partikler som er involvert i en reaksjon, slik at ingen reagens er over eller mangler. For eksempel krever et vannmolekyl to hydrogenatomer og ett oksygenatomer..
Fra disse forgjengerne er begrepet føflekk født. En mol av ethvert stoff er et fast antall partikler som tilsvarer dets molekylære eller atommasse i gram. Dermed ble det bestemt at 12 gram karbon har samme antall partikler som 1 gram hydrogen. Dette tallet er kjent som Avogadros nummer: 6,02 x 10 ^ 23 partikler.
-Eksempel 1
Beregn hvor mange gullatomer som er i 1 gram gull.
Løsning
Det er kjent at gull har en atomvekt på 197. Disse dataene finnes i det periodiske systemet og indikerer at et gullatom er 197 ganger tyngre enn ett av hydrogen og 197/12 = 16,416 ganger tyngre enn karbon..
En mol gull har 6,02 × 10 ^ 23 atomer og har atomvekten uttrykt i gram, det vil si 197 gram.
I ett gram gull er det 1/197 mol gull, det vil si 6,02 × 10 ^ 23 atomer / 197 = 3,06 x10 ^ 23 gullatomer.
-Eksempel 2
Bestem antall molekyler kalsiumkarbonat (CaCO3) som er i 150 gram av dette stoffet. Fortell også hvor mange kalsiumatomer, hvor mange karbon og hvor mange oksygen som er i denne forbindelsen.
Løsning
Det første er å bestemme molekylvekten til kalsiumkarbonat. Det periodiske systemet indikerer at kalsium har en molekylvekt på 40 g / mol, karbon 12 g / mol og oksygen 16 g / mol..
Deretter molekylmassen til (CaCO3) vil være :
40 g / mol + 12 g / mol + 3 x 16 g / mol = 100 g / mol
Hvert 100 gram kalsiumkarbonat er 1 mol. Så i 150 gram tilsvarer de 1,5 mol.
Hvert mol karbonat har 6,02 x 10 ^ 23 karbonatmolekyler, så i 1,5 mol karbonat er det 9,03 x 10 ^ 23 molekyler.
Kort sagt, i 150 gram kalsiumkarbonat er det:
- 9,03 x 10 ^ 23 molekyler av kalsiumkarbonat.
- Kalsiumatomer: 9,03 x 10 ^ 23 .
- Også 9,03 x 10 ^ 23 karbonatomer
- Til slutt 3 x 9,03 x 10 ^ 23 oksygenatomer = 27,09 x 10 ^ 23 oksygenatomer.
Referanser
- Anvendt biologi. Hva er de mikroskopiske målingene? Gjenopprettet fra: youtube.com
- Kjemisk utdanning. Makroskopiske, submikroskopiske og symbolske fremstillinger på materie. Gjenopprettet fra: scielo.org.mx.
- García A. Interaktivt fysikkurs. Makro-stater, mikrostater. Temperatur, entropi. Gjenopprettet fra: sc.ehu.es
- Den mikroskopiske strukturen til materie. Gjenopprettet fra: alipso.com
- Wikipedia. Mikroskopisk nivå. Gjenopprettet fra: wikipedia.com



Ingen har kommentert denne artikkelen ennå.