
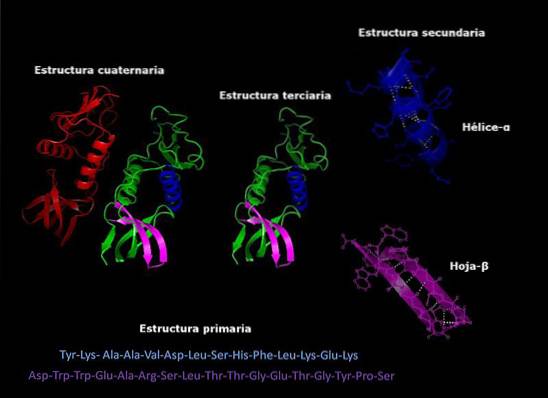
Primær struktur av karakteristiske proteiner
De primær struktur av proteiner Det er rekkefølgen aminosyrene til polypeptidet eller polypeptidene som omfatter dem er ordnet. Et protein er en biopolymer bestående av a-aminosyremonomerer bundet av peptidbindinger. Hvert protein har en definert sekvens av disse aminosyrene.
Proteiner utfører et bredt spekter av biologiske funksjoner, inkludert å forme og opprettholde integriteten til celler gjennom cytoskjelettet, forsvare kroppen mot fremmede stoffer gjennom antistoffer, og katalysere kjemiske reaksjoner i kroppen gjennom enzymer..
I dag er det raskere å bestemme sammensetningen av proteiner og rekkefølgen aminosyrene er ordnet (sekvensering) enn for mange år siden. Denne informasjonen deponeres i internasjonale elektroniske databaser, som er tilgjengelig via internett (blant annet GenBank, PIR).
Artikkelindeks
- 1 Aminosyrer
- 1.1 Alifatiske aminosyrer
- 1.2 Aminosyrer med sidekjeder som inneholder hydroksyl eller svovel
- 1.3 Sykliske aminosyrer
- 1.4 Aromatiske aminosyrer
- 1.5 Grunnleggende aminosyrer
- 1.6 Sure aminosyrer og amider derav
- 2 Peptidbindinger
- 3 Aminosyresekvens
- 4 Koding av proteiner
- 5 Referanser
Aminosyrer
Aminosyrer er molekyler som inneholder en aminogruppe og en karboksylsyregruppe. Når det gjelder α-aminosyrer, har de et sentralt karbonatom (α karbon) som både aminogruppen og karboksylgruppen er bundet til, samt et hydrogenatom og en særegen R-gruppe, som kalles sidekjede.
På grunn av denne konfigurasjonen av α-karbon er aminosyrene som dannes, kjent som α-aminosyrer, chirale. To former produseres som er speilbilder av hverandre og kalles L- og D-enantiomerer..
Alle proteiner i levende vesener består av 20 α-aminosyrer med L-konfigurasjon. Sidekjedene til disse 20 aminosyrene er forskjellige og har et stort mangfold av kjemiske grupper.
I utgangspunktet kan α-aminosyrer grupperes (vilkårlig) avhengig av typen sidekjede som følger.
Alifatiske aminosyrer
I denne gruppen er ifølge noen forfattere Glycine (Gli), Alanine (Ala), Valine (Val), Leucine (Leu) og Isoleucine (Ile). Andre forfattere inkluderer også metionin (Met) og Proline (Pro).
Aminosyrer med hydroksyl- eller svovelholdige sidekjeder
Inneholder Serine (Ser), Cystein (Cys), Treonine (Thr) og også metionin. I følge noen forfattere skal gruppen bare inkludere Ser og Thr.
Sykliske aminosyrer
Består utelukkende av Proline, som, som allerede nevnt, er inkludert av andre forfattere blant de alifatiske aminosyrene.
Aromatiske aminosyrer
Fenylalanin (Phe), tyrosin (Tyr) og tryptofan (Trp).
Grunnleggende aminosyrer
Histidin (His), Lysin (Lys) og Arginin (Arg)
Sure aminosyrer og amider derav
Den inneholder asparaginsyrer (Asp) og glutaminsyrer (Glu) og også amidene Aspargine (Asn) og Glutamine (Gln). Noen forfattere skiller denne siste gruppen i to; på den ene siden av sure aminosyrer (de to første), og på den andre de som inneholder karboksylamid (de resterende to).
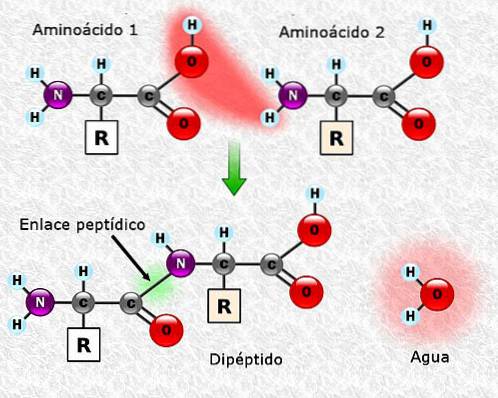
Peptidbindinger
Aminosyrer kan kobles sammen ved hjelp av peptidbindinger. Disse bindingene, også kalt amidbindinger, er etablert mellom α-aminogruppen i en aminosyre og α-karboksylgruppen i en annen. Denne foreningen er dannet med tap av et vannmolekyl.
Forbindelsen mellom to aminosyrer resulterer i dannelsen av et dipeptid, og hvis nye aminosyrer tilsettes, kan tripeptider, tetrapeptider og så videre dannes sekvensielt.
Polypeptider som består av et lite antall aminosyrer kalles vanligvis oligopeptider, og hvis antallet aminosyrer er høyt, kalles de polypeptider..
Hver aminosyre som tilsettes polypeptidkjeden frigjør ett molekyl vann. Den delen av aminosyren som har mistet H + eller OH- under foreningen, kalles aminosyreresten.
De fleste av disse oligopeptid- og polypeptidkjedene vil i den ene enden ha en aminoterminalgruppe (N-terminal) og i den andre en terminal karboksyl (C-terminal). I tillegg kan de inneholde mange ioniserbare grupper mellom sidekjedene til aminosyrerester som utgjør dem. På grunn av dette betraktes de som polyampolitter.
Aminosyresekvens
Hvert protein har en viss sekvens av aminosyrerester. Denne rekkefølgen er det som er kjent som den primære strukturen til proteinet..
Hvert enkelt protein i hver organisme er artsspesifikt. Det vil si at myoglobinet til et menneske er identisk med det til et annet menneske, men det har små forskjeller med myoglobiner fra andre pattedyr..
Mengden og typer aminosyrer et protein inneholder er like viktig som plasseringen av disse aminosyrene i polypeptidkjeden. For å forstå proteiner, må biokjemikere først isolere og rense hvert enkelt protein, deretter gjøre en analyse av aminosyreinnholdet og til slutt bestemme sekvensen..
For å isolere og rense proteiner er det forskjellige metoder, blant annet: sentrifugering, kromatografi, gelfiltrering, dialyse og ultrafiltrering, samt bruk av proteinets løselighetsegenskaper under studiet..
Bestemmelsen av aminosyrene som er tilstede i proteiner, utføres i tre trinn. Den første er å bryte peptidbindinger ved hydrolyse. Deretter skilles de forskjellige typene aminosyrer i blandingen; og til slutt kvantifiseres hver av de oppnådde aminosyretypene.
For å bestemme den primære strukturen til proteinet, kan forskjellige metoder brukes; men for tiden er den mest brukte Edman-metoden, som i utgangspunktet består i å markere og skille den N-terminale aminosyren fra resten av kjeden gjentatte ganger, og identifisere hver aminosyre som frigjøres individuelt.
Proteinkoding
Den primære strukturen til proteiner er kodet i genene til organismer. Genetisk informasjon er inneholdt i DNA, men for oversettelse til proteiner må den først transkriberes til mRNA-molekyler. Hver nukleotidtriplett (kodon) koder for en aminosyre.
Fordi det er 64 mulige kodoner og bare 20 aminosyrer brukes i konstruksjonen av proteiner, kan hver aminosyre kodes av mer enn ett kodon. Nesten alle levende ting bruker de samme kodonene til å kode for de samme aminosyrene. Derfor regnes den genetiske koden som et nesten universelt språk.
I denne koden er det kodoner som brukes til å starte og også stoppe oversettelsen av polypeptidet. Stoppkodonene koder ikke for noen aminosyrer, men stopper translasjon ved C-enden av kjeden, og er representert av triplettene UAA, UAG og UGA..
På den annen side fungerer AUG-kodonen normalt som et startsignal og koder også for metionin..
Etter oversettelse kan proteiner gjennomgå noe prosessering eller modifisering, for eksempel forkorting ved fragmentering, for å oppnå deres endelige konfigurasjon.
Referanser
- C.K. Mathews, K.E. van Holde & K.G. Ahern. 2002. Biokjemi. 3th utgave. Benjamin / Cummings Publishing Company, Inc.
- Murray, P. Mayes, D.C. Granner & V.W. Rodwell. 1996. Harper's Biochemestry. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & L. Stryer (nd). Biokjemi. 5th utgave. W. H. Freeman and Company.
- J. Koolman & K.-H. Roehm (2005). Color Atlas of Biochemistry. tond utgave. Thieme.
- A. Lehninger (1978). Biokjemi. Ediciones Omega, S.A.
- L. Stryer (1995). Biokjemi. W.H. Freeman and Company, New York.


Ingen har kommentert denne artikkelen ennå.