
London styrker egenskaper og eksempler
De London styrker, Spredningskrefter i London, eller induserte dipol-dipol-interaksjoner, er den svakeste typen intermolekylære interaksjoner. Navnet skyldes bidrag fra fysikeren Fritz London og hans studier innen kvantefysikk.
Londons krefter forklarer hvordan molekyler samhandler hvis strukturer og atomer gjør det umulig for ham å danne en permanent dipol; det vil si at det i prinsippet gjelder apolare molekyler eller isolerte atomer av edelgasser. I motsetning til de andre Van der Waals-kreftene, krever denne ekstremt korte avstander.

En god fysisk analogi av London-styrkene kan bli funnet i driften av borrelåsesystemet (bildet ovenfor). Ved å trykke på den ene siden av stoffet brodert med kroker, og den andre med fibre, skapes en attraktiv kraft som er proporsjonal med stoffets areal.
Når begge ansiktene er forseglet, må det utøves en kraft for å motvirke deres samspill (utført av fingrene) for å skille dem. Det samme gjelder molekyler: jo større eller flatere de er, jo større er deres intermolekylære interaksjoner på veldig korte avstander..
Imidlertid er det ikke alltid mulig å nærme seg disse molekylene på en avstand som er nær nok til at deres interaksjoner blir merkbare..
Når dette er tilfelle, krever de svært lave temperaturer eller veldig høyt trykk; som sådan er det tilfellet med gasser. På samme måte kan disse typer interaksjoner være til stede i flytende stoffer (som n-heksan) og faste stoffer (som jod)..
Artikkelindeks
- 1 Funksjoner
- 1.1 Homogen lastfordeling
- 1.2 Polariserbarhet
- 1.3 Den er omvendt proporsjonal med avstanden
- 1.4 Den er direkte proporsjonal med molekylmassen
- 2 Eksempler på London-styrker
- 2.1 I naturen
- 2.2 Alkaner
- 2.3 Halogener og gasser
- 3 Referanser
Kjennetegn
Hvilke egenskaper må et molekyl ha for at det skal samhandle ved hjelp av London-krefter? Svaret er at hvem som helst kan gjøre det, men når det er et permanent dipolmoment, dominerer dipol-dipol-interaksjoner mer enn spredning, noe som bidrar veldig lite til stoffenes fysiske natur..
I strukturer der det ikke er høyelektronegative atomer eller hvis elektrostatiske ladningsfordeling er homogen, er det ingen ekstreme eller regioner som kan betraktes som rik (δ-) eller dårlig (δ +) i elektroner.
I disse tilfellene må andre typer krefter gripe inn, ellers kan disse forbindelsene bare eksistere i gassfasen, uavhengig av trykk eller temperaturforhold som virker på dem..
Homogen lastfordeling
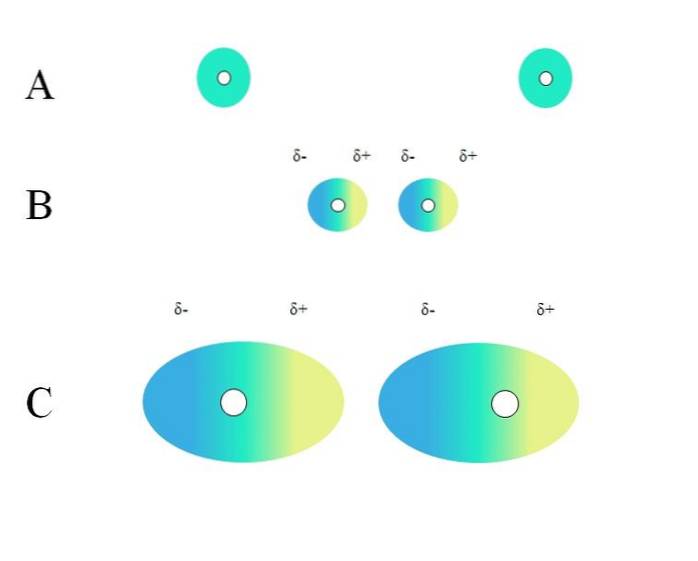
To isolerte atomer, som neon eller argon, har en homogen ladningsfordeling. Dette kan sees i A, toppbilde. De hvite sirkler i sentrum representerer kjernene, for atomer, eller molekylskjelettet, for molekyler. Denne ladningsfordelingen kan betraktes som en grønn elektronsky.
Hvorfor overholder edelgasser denne homogeniteten? Fordi de har sitt elektroniske skall helt fullt, bør elektronene deres teoretisk føle den attraktive ladningen til kjernen like i alle orbitaler..
På den annen side, for andre gasser, for eksempel atomoksygen (O), er skallet dets ufullstendig (som observeres i sin elektroniske konfigurasjon) og tvinger det til å danne det diatomiske molekylet Oto for å kompensere for denne mangelen.
De grønne sirkler i A kan også være molekyler, små eller store. Elektronskyen kretser rundt alle atomene som utgjør den, spesielt de mest elektronegative. Rundt disse atomene vil skyen være konsentrert og være mer negativ, mens andre atomer vil ha en elektronisk mangel.
Denne skyen er imidlertid ikke statisk, men dynamisk, så på et tidspunkt vil det danne seg korte δ- og δ + regioner, og et fenomen som kalles Polarisering.
Polariserbarhet
I A indikerer den grønne skyen en homogen fordeling av negativ ladning. Imidlertid kan den positive tiltrekningskraften som kjernen utøver svinge på elektronene. Dette forårsaker en deformasjon av skyen, og skaper dermed regioner δ-, i blått og δ +, i gult..
Dette plutselige dipolmomentet i atomet eller molekylet kan forvride en tilstøtende elektronsky; med andre ord, det induserer en plutselig dipol på naboen (B, toppbilde).
Dette er fordi δ-regionen forstyrrer naboskyen, dens elektroner føler elektrostatisk frastøting og er orientert på motsatt pol, og ser ut som δ+.
Legg merke til hvordan de positive polene stemmer overens med de negative polene, akkurat som molekyler med permanente dipolmomenter gjør. Jo mer voluminøs elektronskyen er, desto vanskeligere vil kjernen holde den homogen i rommet; og også, jo større deformasjon av den, som man kan se i C.
Derfor er det mindre sannsynlig at atomer og små molekyler blir polarisert av noen partikkel i omgivelsene. Et eksempel på denne situasjonen er illustrert med det lille hydrogenmolekylet, Hto.
For at den skal kondensere, eller enda mer, for å krystallisere, trenger den ublu press for å tvinge molekylene til fysisk samspill.
Det er omvendt proporsjonalt med avstanden
Selv om det dannes øyeblikkelige dipoler som induserer andre rundt seg, er de ikke nok til å holde atomene eller molekylene sammen..
I B er det en avstand d som skiller de to skyene og deres to kjerner. Slik at begge dipoler kan forbli i en vurdert tid, denne avstanden d den må være veldig liten.
Denne tilstanden, et essensielt kjennetegn ved Londons styrker (husk borrelåsen), må oppfylles for at den skal ha en merkbar effekt på materiens fysiske egenskaper..
En gang d er liten, vil kjernen til venstre i B begynne å tiltrekke seg den blå δ- regionen til det nærliggende atomet eller molekylet. Dette vil ytterligere deformere skyen, sett i C (kjernen er ikke lenger i sentrum, men til høyre). Så kommer det et punkt der begge skyene berører og "spretter", men sakte nok til å holde dem sammen en stund..
Derfor er London-styrkene omvendt proporsjonale med avstanden d. Faktisk er faktoren lik d7, så en liten variasjon i avstanden mellom de to atomene eller molekylene vil svekke eller styrke Londons spredning.
Det er direkte proporsjonalt med molekylmassen
Hvordan øke størrelsen på skyene slik at de lettere polariserer? Legge til elektroner, og for det må kjernen ha flere protoner og nøytroner, og dermed øke atommassen; eller å legge til atomer i ryggraden i molekylet, som igjen vil øke dens molekylære masse
På denne måten ville kjerner eller molekylskjelettet være mindre sannsynlig å holde elektronskyen jevn hele tiden. Derfor, jo større de grønne sirkler som er vurdert i A, B og C, jo mer polariserbare vil de være, og jo større vil også deres interaksjoner være av London-styrker..
Denne effekten observeres tydelig mellom B og C, og kan være enda mer hvis sirklene hadde større diameter. Denne resonnementet er nøkkelen til å forklare de fysiske egenskapene til mange forbindelser basert på deres molekylære masse..
Eksempler på London-styrker

I naturen
I hverdagen er det utallige eksempler på Londons spredningskrefter uten å gå ut i den mikroskopiske verdenen i utgangspunktet..
Et av de vanligste og overraskende eksemplene finnes i bena på reptiler kjent som gekko (toppbilde) og i mange insekter (også i Spiderman).
På bena har de pads der tusenvis av små filamenter stikker ut. På bildet kan du se en gecko som poserer i en skråning. For å oppnå dette bruker den intermolekylære krefter mellom fjellet og filamentene på bena..
Hver av disse filamentene samhandler svakt med overflaten som det lille reptilet klatrer på, men siden det er tusenvis av dem, utøver de en kraft proporsjonal med området på bena, sterk nok til at de forblir festet og kan klatre. Geckos er også i stand til å klatre glatte og perfekte overflater som glass..
Alkanes
Alkaner er mettede hydrokarboner som også samhandler av Londons styrker. Deres molekylære strukturer består rett og slett av karbon og hydrogener forbundet med enkeltbindinger. Siden forskjellen i elektronegativiteter mellom C og H er veldig liten, er de apolære forbindelser.
Dermed metan, CH4, det minste hydrokarbonet av alt, koker det ved -161,7 ° C. Når C og H tilsettes skjelettet, oppnås andre alkaner med høyere molekylmasse.
På denne måten oppstår etan (-88,6 ° C), butan (-0,5 ° C) og oktan (125,7 ° C). Legg merke til hvordan kokepunktene deres øker når alkanene blir tyngre.
Dette er fordi deres elektroniske skyer er mer polariserbare og strukturer har større overflateareal, noe som øker kontakten mellom molekylene..
Oktan, selv om det er en apolar forbindelse, har et høyere kokepunkt enn vann.
Halogener og gasser
London-krefter er også til stede i mange gassformige stoffer. For eksempel molekyler av Nto, Hto, COto, Fto, Clto og alle edelgassene, samhandler gjennom disse kreftene, siden de presenterer homogen elektrostatisk fordeling, som kan lide øyeblikkelige dipoler og gi polarisasjoner.
Edelgassene er He (helium), Ne (neon), Ar (argon), Kr (krypton), Xe (xenon) og Rn (radon). Fra venstre til høyre øker kokepunktene med økende atommasser: -269, -246, -186, -152, -108 og -62 ºC.
Halogener samhandler også gjennom disse kreftene. Fluor er en gass ved romtemperatur akkurat som klor. Brom, med høyere atommasse, finnes under normale forhold som en rødaktig væske, og jod danner til slutt et lilla fast stoff som sublimerer raskt fordi det er tyngre enn andre halogener.
Referanser
- Whitten, Davis, Peck & Stanley. Kjemi. (8. utg.). CENGAGE Learning, s 452-455.
- Angeles Mendez. (22. mai 2012). Dispersjonsstyrker (fra London). Gjenopprettet fra: quimica.laguia2000.com
- London Dispersion Forces. Gjenopprettet fra: chem.purdue.edu
- Helmenstine, Anne Marie, Ph.D. (22. juni 2018). 3 typer intermolekylære krefter. Gjenopprettet fra: thoughtco.com
- Ryan Ilagan & Gary L Bertrand. London Dispersion Interactions. Hentet fra: chem.libretexts.org
- ChemPages Netorials. Londons styrker. Gjenopprettet fra: chem.wisc.edu
- Kamereon. (22. mai 2013). Geckoer: Geckoen og styrkene til Van der waals. Gjenopprettet fra: almabiologica.com

Ingen har kommentert denne artikkelen ennå.