
GLUT4-egenskaper, struktur, funksjoner
GLUT4 Det er et glukosetransportørprotein med 509 aminosyrer som har høy affinitet for dette sukkeret. Den tilhører den store hovedfamilien til tilretteleggere (Leger Uten Grenser) som er preget av å ha 12 transmembrane alfa-spiraler. Som alle medlemmer av denne familien, formidler den den lette transporten av glukose til fordel for konsentrasjonsgradienten..
Plasseringen er begrenset til celler som er følsomme for insulinstimulering, slik som adipocytter og myocytter. I denne forstand spiller GLUT4 stjernene i den primære mekanismen for glukoseabsorpsjon under forhold med hyperglykemi i blodet..
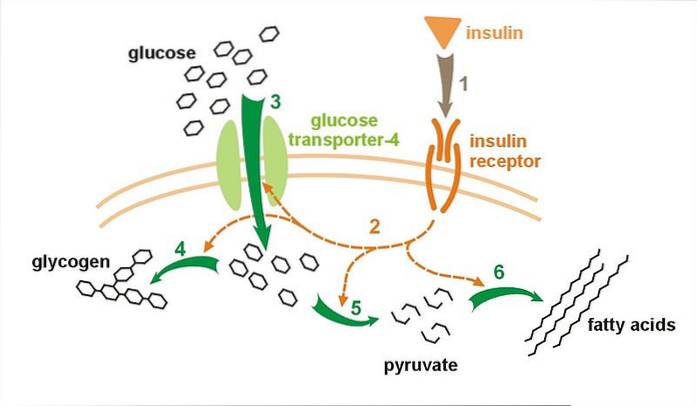
Cirka 95% av GLUT4 syntetisert av cellen forblir bosatt i cytosolen i vesiklene. Disse vesiklene smelter sammen med plasmamembranen og eksponerer reseptoren deri som respons på aktivering av insulinmediert eksocytose..
Skjelettmuskulær trening er også i stand til å fremme flytting av denne transportøren i cellemembranen, gitt det høye energibehovet som disse cellene har under disse forholdene. Signalene som stimulerer syntese under langvarig fysisk aktivitet er imidlertid fortsatt ukjente..
Artikkelindeks
- 1 Funksjoner
- 2 Struktur
- 2.1 Hvordan skjer glukosetransport gjennom GLUT4?
- 3 funksjoner
- 3.1 Mobilisering av GLUT4-vesikler fra cytosolen til membranen
- 4 Referanser
Kjennetegn
I likhet med den konstituerende ekspresjonstransportøren GLUT1 har GLUT4 en høy affinitet for glukose, noe som oversettes til en evne til å binde glukose selv når konsentrasjonen av dette sukkeret i blodet når svært lave verdier.
I motsetning til isoformene som er ansvarlige for glukosetransport under basale forhold (GLUT1 og GLUT3), uttrykkes ikke denne transportøren i den embryonale cellemembranen..
Tvert imot uttrykkes det bare i celler i voksen vev, hovedsakelig i perifert vev rikt på høye konsentrasjoner av brunt fett som hjerte, skjelettmuskulatur og fettvev. Imidlertid har det også blitt oppdaget i cellene i hypofysen og hypothalamus.
I denne forstand er det viktig å markere at distribusjonen er begrenset til celler som er følsomme for variasjoner i insulinkonsentrasjoner, er relatert til det faktum at den presenterer regulert uttrykk av dette hormonet. Annen forskning har vist at muskelsammentrekning også er i stand til å utøve en regulatorisk effekt på uttrykket av denne transportøren..
På den annen side har subcellulære lokaliseringsstudier vist at GLUT2 har en dobbel plassering mellom cytosolen og membranen. I det cytosoliske rommet der den høyeste prosentandelen er lokalisert, ligger det i forskjellige rom: i transgolgi-nettverket, det tidlige endosomet, vesikler belagt eller ikke av klatrin og tubulovesikulære cytoplasmatiske strukturer.
Struktur
Som alle medlemmer av familien av glukosetransportere som er involvert i den lette passive transporten av denne heksosen (GLUT), er GLUT4 et α-helix multipass transmembranprotein.
12 transmembransegmenter i α-helix-konfigurasjon krysser plasmamembraner og subcellulære rom (vesikler) av celler der GLUT 4 uttrykkes.
Helices 3, 5, 7 og 11 er romlig fordelt for å gi opphav til dannelsen av en hydrofil kanal gjennom hvilken transitt av monosakkaridet skjer fra det ekstracellulære rommet til cytosolen til fordel for en konsentrasjonsgradient..
Proteinets amino- og karboksylterminer er orientert mot cytoplasmaet, i en konformasjonskonfigurasjon som gir opphav til dannelsen av en stor sentral sløyfe.
Området avgrenset av begge ender representerer en funksjonelt viktig region av proteinet siden det er involvert i både glukoseopptak og binding og i responsen på insulinsignalering. I tillegg til at den styres fra de cytosoliske vesikulære avdelingene til plasmamembranen der den vil utøve sin funksjon som transportør.
Hvordan skjer glukosetransport gjennom GLUT4?
Som alle medlemmer av familien av glukosetransportere som er involvert i den lette passive transporten av denne heksosen (GLUT), er GLUT4 et transmassbranprotein i flere passasjer i α-helix.
En deformasjon av strukturen indusert ved binding av sukker mobiliserer bindingsstedet fra membranens ytre dyse til cytosolen der det frigjøres. Når dette har skjedd, får transportøren sin opprinnelige konformasjon igjen, og utsetter stedet for glukose på yttersiden av membranen..
Funksjoner
Glukosetransportørproteinet av GLUT4-typen er ansvarlig for å utføre mobilisering av glukose fra det ekstracellulære mediet til cytosolen, som respons på stimulansen som genereres av den forbedrede utskillelsen av insulin i celler i vev som er følsomme for dette hormonet, slik som de som integrere skjelettmuskulatur og fettvev.
For bedre å forstå dette er det viktig å huske at insulin er et hormon som frigjøres av β-celler i bukspyttkjertelen som respons på høye konsentrasjoner av glukose i blodet, og setter i gang fysiologiske mekanismer som fremmer dets absorpsjon av celler så vel som syntesen. av glykogen..
Gitt følsomheten til GLUT4 for dette hormonet, fungerer det som hovedpersonen i den primære reguleringsmekanismen for glukoseabsorpsjon. Spiller en nøkkelrolle i rask mobilisering av glukose fra blodet når monosakkaridkonsentrasjoner når svært høye verdier. Sistnevnte er viktig for å opprettholde cellehomeostase.
Denne raske absorpsjonen av glukose er mulig på grunn av den høye affiniteten som denne transportøren har for dette sukkeret. Med andre ord er den i stand til å oppdage den selv ved lave konsentrasjoner, raskt binde eller fange den..
På den annen side forklarer evnen til å oppdage glukose ved lave konsentrasjoner viktigheten av GLUT4-uttrykk i skjelettmuskulaturen under trening, en aktivitet som har et høyt energibehov.
GLUT4 vesikelmobilisering fra cytosol til membran
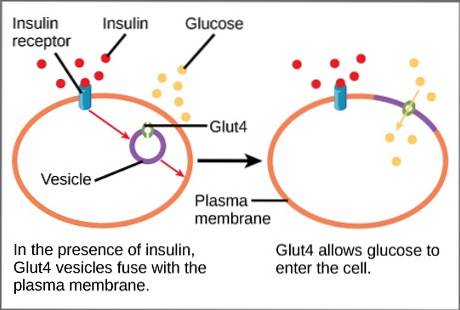
I fravær av insulinstimulering rekrutteres ca. 95% av GLUT4 til cytoplasmaet i vesikler fra trans Golgi-nettverket..
Når glukosekonsentrasjonen langt overstiger den fysiologiske verdien, utløses en signalkaskade som fører til frigjøring av insulin fra bukspyttkjertelen.
Det frigitte insulinet er nå i stand til å binde seg til insulinreseptoren som er tilstede på membranen til myocytter og adipocytter, og sende de nødvendige signalene for å utløse aktivering av eksocytose. Sistnevnte resulterer i fusjon av GLUT4-bærende vesikler med plasmamembranen..
Denne fusjonen øker forbigående konsentrasjonen av transportøren i membranen til disse cellene. Når blodsukkernivået faller til baseline, forsvinner stimulansen og transportøren resirkuleres ved aktivering av endocytose..
Referanser
- Bryant NJ, Govers R, James DE. Regulert transport av glukosetransportøren GLUT4. Nat Rev Mol Cell Biol.2002; 3 (4): 267-277.
- Henriksen EJ. Invitert anmeldelse: Effekter av akutt trening og trening på insulinresistens. J Appl Physiol (1985). 2002; 93 (2): 788-96.
- Huang S, tsjekkiske parlamentsmedlem. GLUT4 glukosetransportør. Cell Metab. 2007; 5 (4): 237-252.
- Kraniou Y, Cameron-Smith D, Misso M, Collier G, Hargreaves M. Effekter av trening på GLUT4 og glykogenin-genuttrykk i menneskelig skjelettmuskulatur. J Appl Physiol (1985). 2000; 88 (2): 794-6.
- Pessin JE, Thurmond DC, Elmendorf JS, Coker KJ, Okada S. Molekylært grunnlag for insulinstimulert GLUT4-vesikelhandel. Biol Chem. 1999; 274 (5): 2593-2596.
- Schulingkamp RJ, Pagano TC, Hung D, Raffa RB. Insulinreseptorer og insulinvirkning i hjernen: gjennomgang og kliniske implikasjoner. Nevrovitenskap og bioadferd. 2000; 855-872.
- Wood IS, Trayhurn P. Glukosetransportør (GLUT og SGLT): utvidede familier av sukkertransportproteiner. Br J Nutr. 2003; 89 (1): 3-9. Zhao FQ, Keating AF. Funksjonelle egenskaper og genomikk til glukosetransportører. Curr Genomics. 2007; 8 (2): 113-28.



Ingen har kommentert denne artikkelen ennå.