
Alkylhalogenidegenskaper, fremstilling, eksempler

De alkylhalogenider er organiske forbindelser der et karbonatom med sp-hybridisering3 er kovalent bundet til et halogen (F, Cl, Br, I). Fra et annet perspektiv er det praktisk, å forenkle, å anta at de er haloalkaner; dette er alkaner som noen H-atomer har blitt erstattet av med halogenatomer.
Som navnet antyder, må halogenatomer også være knyttet til alkylgrupper, R, for å bli betraktet som denne typen halogenid; selv om de strukturelt kan være substituert eller forgrenet og ha aromatiske ringer, og fortsatt være et alkylhalogenid.
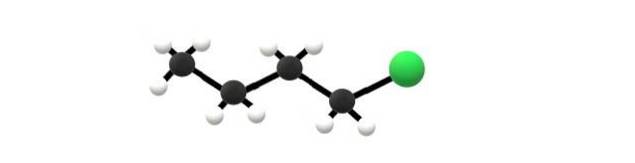
Ovenfor er 1-klorbutanmolekylet, som tilsvarer et av de enkleste alkylhalogenidene. Det kan sees at alle karbonene har enkeltbindinger, og også har hybridisering3. Derfor er den grønne sfæren, som tilsvarer Cl-atomet, knyttet til et skjelett avledet fra alkanbutan.
Enda enklere eksempler enn 1-klorbutan er de som stammer fra metangass: det minste hydrokarbonet av alle.
Fra molekylet CH4 H-atomer kan erstattes av for eksempel jod. Hvis en H er erstattet, vil vi ha CH3I (jodmetan eller metyljodid). Ved å erstatte to H vil vi ha CHtoJegto (diiodometan eller metylenjodid). Så og til slutt erstatter jeg alle H-er ved å gi CHI3 (jodform) og CI4 (karbontetraiodid).
Alkylhalogenider kjennetegnes ved å være veldig reaktive, og ved å ha de mest elektronegative atomer i det periodiske systemet, er det intuitert at de gjennom endeløse mekanismer påvirker biologiske matriser.
Artikkelindeks
- 1 Egenskaper av alkylhalogenider
- 1.1 Koke- og smeltepunkter
- 1.2 Polaritet
- 1.3 Løsemiddelkraft
- 2 Nomenklatur
- 2.1 Eksempel
- 3 Motta
- 3.1 Halogenering med lys eller ultrafiolett stråling
- 3.2 Tilsetning av hydrokider eller halogener til alkener
- 4 Reaksjoner
- 4.1 Nukleofil erstatning
- 4.2 Avhending
- 4.3 Syntese av Grignard-reagenser
- 5 eksempler
- 6 bruksområder
- 6.1 Løsemiddel
- 6.2 Organisk syntese
- 6.3 Farmasøytisk industri
- 6.4 Kjølemidler
- 7 Referanser
Egenskaper av alkylhalogenider
Egenskapene til denne familien av forbindelser avhenger av deres molekylære strukturer. Imidlertid, sammenlignet med de av dets avledede alkaner, kan bemerkelsesverdige forskjeller observeres forårsaket av det enkle faktum å ha C-X-bindinger (X = halogenatom).
Det vil si at C-X-bindingene er ansvarlige for enhver forskjell eller likhet mellom ett eller flere alkylhalogenider..
Til å begynne med er CH-bindingene nesten apolare, gitt den lille elektronegativitetsforskjellen mellom C og H; på den annen side presenterer C-X-bindingene et permanent dipolmoment på grunn av at halogener er mer elektronegative enn karbon (spesielt fluor).
På den annen side er noen halogener lette (F og Cl), mens andre er tunge (Br og I). Atommassene deres former også forskjeller innenfor C-X-bindingene; og i sin tur direkte på egenskapene til halogenidet.
Derfor er tilsetning av halogener til et hydrokarbon lik å øke dets polaritet og molekylvekt. tilsvarer å gjøre det mindre flyktig (opp til et punkt), mindre brannfarlig, og øke kokepunktet eller smeltepunktene.
Koke- og smeltepunkter
Når det er sagt ovenfor, vises størrelsen og derfor vekten av de forskjellige halogenene i økende rekkefølge:
F < Cl < Br < I
Således kan alkylhalogenider som inneholder F-atomer forventes å være lettere enn de som inneholder Br- eller I-atomer..
For eksempel anses noen halogenider avledet fra metan:
CH3F < CH3Cl < CH3Br < CH3Jeg
CHtoFto < CHtoClto < CHtoBrto < CHtoJegto
Og så videre for de andre derivatproduktene med en høyere grad av halogenering. Merk at rekkefølgen opprettholdes: fluorhalogenider er lettere enn jodhalogenider. Ikke bare det, men også deres kokepunkter og smeltepunkter adlyder også denne ordren; RF koker ved lavere temperaturer enn RI (R = CH3, for denne saken).
På samme måte er alle disse væskene fargeløse, siden elektroner ikke kan absorbere eller frigjøre fotoner i deres C-X-bindinger for å overføre andre energinivåer. Når de blir tyngre, kan de imidlertid krystallisere og vise farger (det samme gjør iodoform, CHI3).
Polaritet
C-X obligasjoner er forskjellige i polaritet, men i omvendt rekkefølge som ovenfor:
C-F> C-Cl> C-Br> C-I
Derfor er CF-obligasjoner mer polare enn C-I-obligasjoner. Å være mer polar, har RF-halogenider en tendens til å samhandle gjennom dipol-dipolkrefter. I mellomtiden, i RBr- eller RI-halogenider, er dipolmomentene svakere, og interaksjonene styrt av Londons dispersjonsstyrker får større styrke..
Løsemiddelkraft
Siden alkylhalogenidene er mer polare enn alkanene som de er avledet fra, øker de deres evne til å oppløse et større antall organiske forbindelser. Det er av denne grunn at de pleier å være bedre løsningsmidler; selv om det ikke betyr at de kan erstatte alkaner i alle applikasjoner.
Det er tekniske, økonomiske, økologiske og ytelseskriterier som foretrekker et halogenert løsningsmiddel fremfor et alkan.
Nomenklatur
Det er to måter å navngi et alkylhalogenid: med dets vanlige navn eller ved dets systematiske navn (IUPAC). Vanlige navn er vanligvis mer praktiske å bruke når RX er enkelt:
CHCl3
Kloroform: vanlig navn
Metyltriklorid eller triklormetan: IUPAC-navn.
Men systematiske navn er å foretrekke (og det eneste alternativet) når du har forgrenede strukturer. Ironisk nok er vanlige navn nyttige igjen når strukturene er for kompliserte (som de som vil bli sett i den siste delen).
Reglene for å navngi en forbindelse i henhold til IUPAC-systemet er de samme som for alkoholer: hovedkjeden er identifisert, som er den lengste eller den mest forgrenede. Deretter er karbonene oppført fra slutten nærmest substituentene eller grenene, navngitt i alfabetisk rekkefølge.
Eksempel
For å illustrere det har vi følgende eksempel:
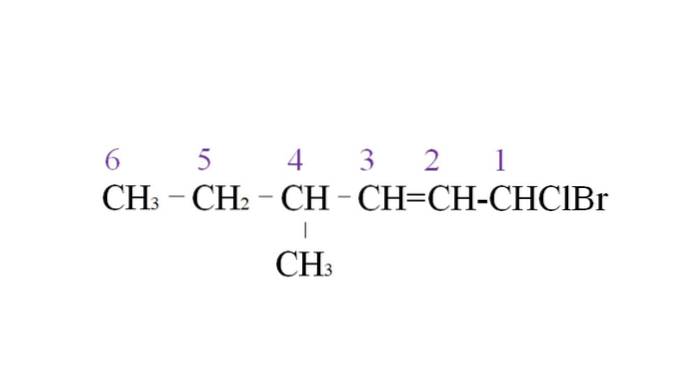
Den første grenen er metylgruppen ved C-4; men ettersom det er dobbeltobligasjon, får den høyere prioritet fremfor den oppgitte regelen. Av denne grunn begynner den lengste kjeden å bli oppført fra høyre, ledet av et karbonatom knyttet til to halogener: Cl og Br.
Med opptellingen blir substituentene navngitt i alfabetisk rekkefølge:
1-brom-1-klor-4-metyl-2-heksen.
Å skaffe
For å oppnå alkylhalogenidene, må molekylene underkastes en halogeneringsprosess; det vil si innlemme halogenatomer i strukturene, spesielt et atom med karbon sp3.
Det er to metoder for å oppnå eller syntetisere dem: ved ultrafiolett stråling gjennom en fri radikalmekanisme, eller ved å tilsette hydroksider eller halogener..
Halogenering med lys eller ultrafiolett stråling
Den første, den minst passende og med dårligst ytelse, består i å bestråle alkanene med ultrafiolett stråling (hv) i nærvær av et halogen. For eksempel er ligningene for klorering av metan vist:
CH4 + Clto => CH3Cl + HCl (under UV-lys)
CH3Cl + Clto => CHtoClto + HCl
CHtoClto + Clto => CHCl3 + HCl
CHCl3 + Clto => CCl4 + HCl
De fire forbindelsene (CH3Cl, CHtoClto, CHCl3 og CCl4) dannes, og derfor har du en blanding som kan utsettes for brøkdestillasjon. Imidlertid er denne metoden upraktisk, og det er foretrukket å bruke organiske synteser..
Et annet eksempel er bromering av n-heksan:
CH3CHtoCHtoCHtoCHtoCH3 + Brto => CH3(Br) CHCHtoCHtoCHtoCH3 + HBr
Igjen, i denne reaksjonen brukes lys eller ultrafiolett stråling for å fremme dannelsen av frie radikaler. Brom, da det er en dyp rød væske, blir misfarget når det reagerer, og observerer dermed en fargeendring fra rød til fargeløs når 2-bromheksan dannes..
Tilsetning av hydrokider eller halogener til alkener
Den andre metoden for å oppnå alkylhalogenider består av behandling av alkoholer (ROH) eller alkener (RtoC = CRto) med hydroksider. Hydracids har den generelle formelen HX (HF, HCl, HBr og HI). Et eksempel vil bli vist ved bruk av etanol for hver av dem:
CH3CHtoOH + HF => CH3CHtoF + HtoELLER
CH3CHtoOH + HCl => CH3CHtoCl + HtoELLER
CH3CHtoOH + HBr => CH3CHtoBr + HtoELLER
CH3CHtoOH + HI => CH3CHtoJeg + HtoELLER
På samme måte kan alkener legge til HX-molekyler til dobbeltbindinger, og danne sekundære alkylhalogenider..
CHto= CH-CH3 + HBr => BrCHto-CHto-CH3 + CH3-CHBr-CH3
BrCH-produktetto-CHto-CH3 er 1-brompropan, og CH3-CHBr-CH3 2-brompropan. Det andre er majoritetsproduktet fordi det er det mest stabile, mens det første produseres i mindre grad fordi det er mer ustabilt. Dette er fordi CH3CHBrCH3 er et sekundært alkylhalogenid.
Svært likt oppstår når det som tilsettes alkenet er et molekyl av Xto:
CHto= CH-CH3 + Brto => BrCHto-CHBr-CH3
Imidlertid oppnås et alkylhalogenid med to bromatomer bundet til tilstøtende karbonatomer; vicinal alkylhalogenid. Hvis du derimot hadde de to brominene festet til samme karbon, ville du ha et geminalalkylhalogenid, som følgende:
BrtoCH-CHto-CH3
Reaksjoner
Nukleofil erstatning
Reaktivitetene til alkylhalogenider er basert på sprøheten eller styrken til C-X-bindingen. Jo tyngre halogen, jo svakere er båndet, og jo lettere vil det bryte. I en kjemisk reaksjon brytes bindinger og nye dannes; C-X obligasjoner er brutt, for å danne en C-G binding (G = ny gruppe).
I mer passende termer fungerer X som en forlatende gruppe, og G som en inngående gruppe i en reaksjon av nukleofil substitusjon. Hvorfor oppstår denne reaksjonen? Fordi X, som er mer elektronegativ enn karbon, "stjeler" elektrondensitet, og etterlater det et underskudd av elektroner som oversettes som en positiv delvis ladning:
Cδ+-Xδ-
Hvis en negativ art (: G-) eller nøytral med et tilgjengelig elektronpar (: G), som er i stand til å danne en mer stabil C-G-binding, vil X ende opp med å bli erstattet av G. Ovenstående kan representeres av følgende kjemiske ligning:
RX +: G- => RG + X-
Jo svakere C-X eller R-X-bindingen er, jo større er reaktiviteten eller tendensen til å bli erstattet av nukleofilt middel (eller nukleofil) G; det vil si elskere av kjerner eller positive ladninger.
Eksempler
En serie generelle ligninger for de nukleofile substitusjonene som alkylhalogenider kan gjennomgå, er vist nedenfor:
RX + OH- => ROH + X- (Alkoholer)
+ ELLER'- => ROR' (Ethers, Williamson-syntese)
+ Jeg- => RI (Alkyljodider)
+ CN- => RCN (nitriler)
+ R'COO- => RCOOR '(Estere)
+ NH3 => RNHto (Amines)
+ P (C6H5)3 => RP (C6H5)3+ X- (Fosfoniumsalter)
+ SH- => RSH (tioler)
Fra disse eksemplene kan det allerede mistenkes hvor verdifulle alkylhalogenider er for organiske synteser. En av de mange erstatningene som fortsatt ble sitert er den fra Friedel Crafts-reaksjonen, som brukes til å "leie" aromatiske ringer:
RX + ArH + AlCl3 => ArR
I denne reaksjonen erstattes en H av den aromatiske ringen med en R-gruppe fra RX.
Eliminering
Alkylhalogenider kan frigjøre HX-molekyler gjennom en eliminasjonsreaksjon; spesielt en dehydrohalogenering:
RtoCH-CXRto + Åh- => RtoC = CRto + HX
Det sies at dehydrohalogenering oppstår fordi både et H og et X går tapt i det samme HX-molekylet.
Syntese av Grignard-reagenser
Alkylhalogenider kan reagere med visse metaller for å danne Grignard-reagenset, brukt til å tilsette R-grupper til andre molekyler. Den generelle ligningen for syntese er som følger:
RX + Mg => RMgX
Eksempler
Ulike eksempler på alkylhalogenider har allerede blitt nevnt i avsnittene. Noen andre, enkle, er:
-Etylklorid, CH3CHtoCl
-Isopropylfluorid, (CH3)toCHtoF
-2-metyl-3-klorpentan, CH3-CH (CH3) -CHCl-CHtoCH3
-sek-butyljodid, CH3CHtoCHtoI-CH3
-3-brom-6-jodheptan, CH3-CHto-CHBr-CHto-CHto-CHtoJeg
-3,4-dibromo-1-penten, CH3-CHBr-CHBr-CH = CHto
applikasjoner
Løsemiddel
I tidligere seksjoner ble nevnt løsningsmiddelkapasiteten til alkylhalogenidene. Industrien har benyttet seg av denne egenskapen til å bruke dem som rengjøringsmidler, enten det gjelder tekstilmaterialer, elektroniske komponenter eller for å fjerne lakkflekker..
På samme måte brukes de som løsningsmidler for maling, eller organiske eller fettete prøver for utallige typer analytiske tester..
Organisk syntese
Alkylhalogenider er veldig nyttige for "alkylering" av aromatiske ringer, mens de tjener som en startkilde for syntesen av praktisk talt alle andre familier av organiske forbindelser. Syntetisk betraktes RX som en kilde til R-grupper eller -kjeder, som kan være ønsket for inkorporering i sterkt aromatiske forbindelser..
Legemiddelindustrien
Det ble nevnt i begynnelsen at halogenatomer samhandler med biologiske matriser, slik at de i organismer ikke kan gå ubemerket uten å generere en endring, positiv eller negativ. Hvis et medikament har en positiv effekt på kroppen og har et halogenatom, kan denne effekten eventuelt økes.
Så hvis X er direkte bundet til et sp-hybridisert karbon3, den vil ha et alkylhalogenid og ikke et halogenert derivat. Noen av slike halogenider er vist nedenfor i følgende bildeserie:
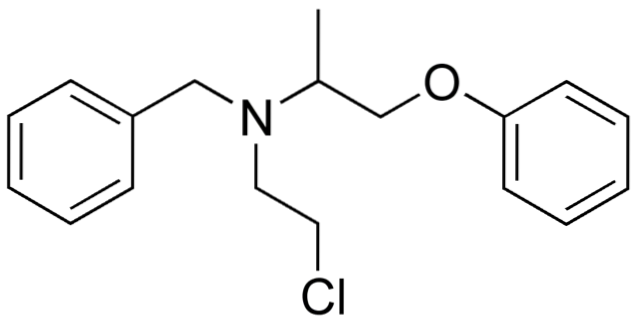
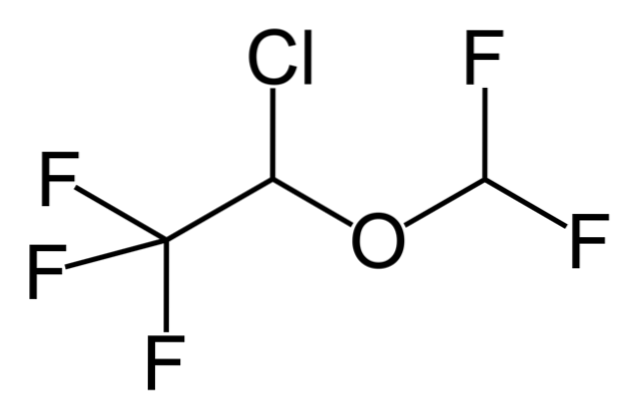

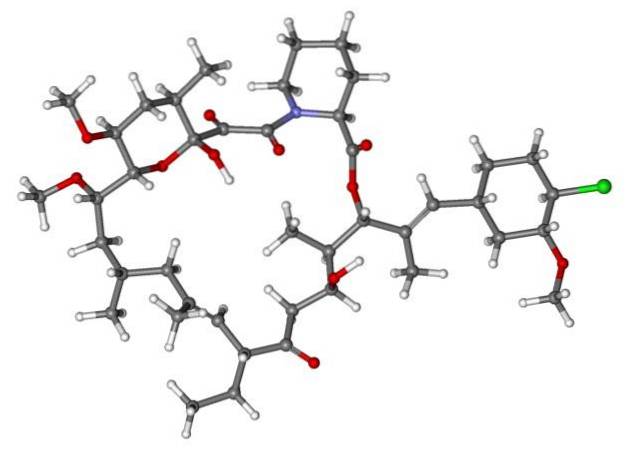

Merk at i disse fem medikamentene er det minst en binding av CH-typento-X eller CH-X; det vil si at halogenet er festet til et sp karbon3.
Kjølemidler
Det berømte kjølemediet Freon-12 (CHCIFto), i likhet med andre fluoralkaner eller fluorkarboner, erstattet ammoniakkgasser og klorfluorkarboner (CFC) i denne funksjonen, selv om de er ikke-flyktige eller giftige stoffer, ødelegger de ozonlaget; mens freon-12, som er mer reaktiv, blir ødelagt før den når slike høyder.
Referanser
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Clark Jim. (2016, 14. juli). Bruk av alkylhalogenider. Kjemi LibreTexts. Gjenopprettet fra: chem.libretexts.org
- Gál, B., Bucher, C., & Burns, N. Z. (2016). Chiral Alkyl Halides: Underutforskede motiver i medisin. Marine drugs, 14 (11), 206. doi: 10.3390 / md14110206
- Alkylhalider. Gjenopprettet fra: chemed.chem.purdue.edu
- Patkar Prachi. (16. juli 2017). Alt om alkylhalogenider: egenskaper, bruksområder og mye mer. Vitenskap slo. Gjenopprettet fra: sciencestruck.com
- R. Skip. (2016). Alkylhalider. Gjenopprettet fra: hyperphysics.phy-astr.gsu.edu
- Læringsveiledning for kapittel 9 - Alkylhalider I. Gjenopprettet fra: cactus.dixie.edu
- Q.A. Eduardo Vega Barrios. (s.f.). Alkylhalogenider: Egenskaper, bruksområder og applikasjoner. [PDF. Gjenopprettet fra: cvonline.uaeh.edu.mx



Ingen har kommentert denne artikkelen ennå.