
Magnesiumhydroksidstruktur, egenskaper, nomenklatur, bruksområder
De magnesiumhydroksid er en uorganisk forbindelse hvis kjemiske formel er Mg (OH)to. I sin rene form er det et kjedelig hvitt fast stoff med et amorft utseende; Imidlertid forvandles det med et lite og nøyaktig innhold av urenheter til den krystallinske faste brucitten, et mineral som finnes i visse avsetninger i naturen, og er en rik kilde til magnesium..
Det er en svak elektrolytt eller base, så dens dissosiasjon er lite vann. Denne eiendommen gjør Mg (OH)to en god surhetsnøytralisator for konsum; middel populært kjent som melk av magnesia suspensjon. Det er også et brannhemmende middel ved å slippe ut vann under dets termiske nedbrytning..

I det øvre bildet vises noen magnesiumhydroksydfaststoffer, der dens ugjennomsiktige hvite farge kan forstås. Jo mer krystallinske de er, de utvikler glassaktige og perleformede overflater.
Den krystallinske strukturen er spesiell siden den etablerer dobbeltlags sekskantede krystaller, som er lovende design for design av nye materialer. I disse lagene spiller deres positive ladninger en viktig rolle på grunn av substitusjon av Mgto+ av treverdige kationer, og arten begrenset mellom veggene sammensatt av OH-anioner-.
På den annen side kommer andre anvendelser avhengig av morfologien til de preparerte partiklene eller nanopartiklene; som katalysatorer eller adsorbenter. I alle av dem holdes forholdet 1: 2 for Mg-ioner konstant.to+: ÅH-, reflektert i samme formel Mg (OH)to.
Artikkelindeks
- 1 Struktur
- 1.1 Formel og oktaeder
- 1.2 Dobbeltlag
- 1.3 Morfologier
- 2 eiendommer
- 2.1 Fysisk utseende
- 2.2 Molarmasse
- 2.3 Tetthet
- 2.4 Smeltepunkt
- 2.5 Løselighet i vann
- 2.6 Brytningsindeks
- 2,7 pH
- 2.8 Varmekapasitet
- 3 Hvor ligger den?
- 4 Nomenklatur
- 5 bruksområder
- 5.1 Nøytraliseringsmiddel
- 5.2 Antacida
- 5.3 Brannhemmende
- 5.4 Katalysator
- 5.5 Adsorbens
- 6 Referanser
Struktur
Formel og oktaeder
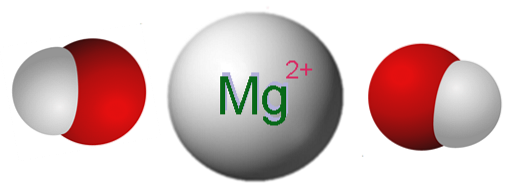
Bildet over viser ionene som utgjør Mg (OH)to. Som det kan sees, er det to OH-anioner- for hvert mg-kationto+, som samhandler elektrostatisk for å definere en krystall med en sekskantet struktur. Den samme formelen indikerer at forholdet Mg: OH er 1: 2.
Imidlertid er den sanne krystallstrukturen litt mer intrikat enn å anta enkle Mg-ioner.to+ og OH-. Faktisk er magnesium preget av å ha et koordinasjonstall på 6, slik at det kan samhandle med opptil seks OH-.
Dermed dannes oktaeder Mg (OH)6, hvor oksygenatomene åpenbart kommer fra OH-; og krystallstrukturen hviler nå på vurderingen av slik oktaeder og hvordan de samhandler med hverandre.
Enhetene Mg (OH) er faktisk6 ende opp med å definere dobbeltlagsstrukturer som i sin tur er ordnet i rommet for å opprette den sekskantede krystall.
Dobbelt lag
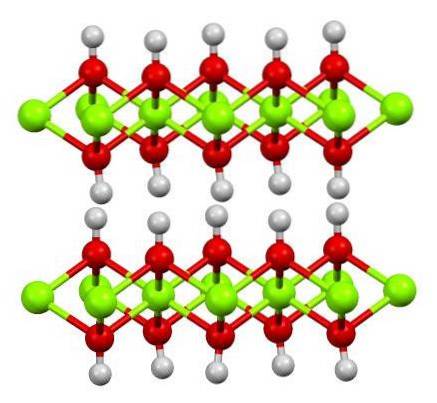
Det øverste bildet viser magnesiumlagets hydroksyd (LDH) dobbeltlagsstruktur: Lagdelte doble hydroksider). De grønne kulene representerer Mg-ionerto+, som kan erstattes av andre med høyere ladning for å generere en positiv ladning i laget.
Legg merke til at rundt hver mgto+ det er seks røde kuler koblet til deres respektive hvite kuler; det vil si de oktaedriske enhetene Mg (OH)6. OH- fungerer som en bro for å bli med to mgto+ av forskjellige plan, noe som gjør at lagene er sammenflettet.
På samme måte observeres det at hydrogenatomer peker opp og ned, og er primært ansvarlige for de intermolekylære kreftene som holder de to lagene av Mg (OH) enheter sammen.6.
Nøytrale molekyler (som alkoholer, ammoniakk og nitrogen) eller til og med anioner kan legge seg mellom disse lagene, avhengig av hvor positive de er (hvis det er Al-ioner3+ o Tro3+ erstatter Mgto+). "Filler" av disse artene er begrenset av overflatene som består av OH-anionene-.
Morfologier
Dobbeltlags, sekskantet glass vokser sakte eller raskt. Alt avhenger av syntesen eller preparatparametrene: temperatur, molforhold, omrøring, løsningsmidler, reagenser som kilde til magnesium, baser eller utfellingsmidler, etc. Når krystallet vokser, definerer det mikrostrukturen eller morfologien til nanopartiklene eller aggregatene.
Dermed kan disse nanopartiklene ha blomkållignende plate, blodplater eller kuleformede morfologier. Likeledes kan fordelingen av størrelsene endres, og det samme kan porøsiteten til de resulterende faste stoffene..
Eiendommer
Fysisk utseende
Det er et hvitt, granulært eller pulverisert fast stoff og luktfritt.
Molarmasse
58,3197 g / mol.
Tetthet
3,47 g / ml.
Smeltepunkt
350 ° C. Ved denne temperaturen brytes den ned i oksid ved å frigjøre vannmolekylene i krystallene:
Mg (OH)to(s) => MgO (s) + HtoO (g)
Vannløselighet
0,004 g / 100 ml ved 100 ° C; det vil si at den knapt løses opp i kokende vann, noe som gjør den til en uoppløselig forbindelse i vann. Når imidlertid pH synker (eller surheten øker), øker dens løselighet på grunn av dannelsen av det vandige komplekset, Mg (OHto)6.
På den annen side, hvis Mg (OH)to har absorbert COto, vil frigjøre tilbakeholdt gass som brus når den er oppløst i et surt medium.
Brytningsindeks
1,559
pH
En vandig suspensjon derav har en pH som varierer mellom 9,5 og 10,5. Selv om disse verdiene er normale, gjenspeiler det dens lave basalitet sammenlignet med andre metallhydroksider (som NaOH).
Varmekapasitet
77,03 J / mol K
Hvor befinner det seg?

Magnesiumhydroksid kan finnes i naturen som mineralbrucitt, som er preget av sin gjennomsiktige hvite farge, med grønne eller blåaktige toner, avhengig av urenheter. Likeledes er brucitt en del av noen leire, som kloritt, da det er klemt mellom lagene av silikater, sammenføyd av metallioner..
I brucitt er det andre ioner i tillegg til Mgto+, som Al3+, Tro3+, Znto+ og Mnto+. Malmene finnes i forskjellige regioner eller innsjøer i Skottland, Canada, Italia og USA..
Fysisk ser krystallene ut som smeltet glass (øvre bilde), med hvite, grå, blå eller grønne farger, og gjennomsiktige i sjeldne eksemplarer..
Dette mineralet er en av de onder som påvirker sement og betong, siden det har en tendens til å ekspandere og forårsake brudd i dem. Imidlertid absorberer den ikke COto, slik at kalsinering ikke bidrar til drivhuseffekten, og det er derfor en passende mineralogisk kilde (og den rikeste) for å oppnå magnesium, i tillegg til sjøvann.
Nomenklatur
Mg (OH)to Den har opptil tre IUPAC-aksepterte navn (utenfor mineralogi eller medisin). Disse er veldig like hverandre, siden måten de ender opp nesten ikke varierer på..
For eksempel tilsvarer 'magnesiumhydroksid' navnet i henhold til stamnomenklaturen, og utelater (II) på slutten fordi +2 nesten som standard er den eneste oksidasjonstilstanden til magnesium.
'Magnesium dihydroxide', som angir antall OH-ioner med det greske tellerprefikset- angitt i formelen i henhold til den systematiske nomenklaturen. Og 'magnesiumhydroksid', som slutter med suffikset -ico for å være den maksimale og "eneste" oksidasjonstilstanden til magnesium, i henhold til den tradisjonelle nomenklaturen..
De andre navnene, for eksempel brucitt eller melkemagnesia, selv om de er direkte relatert til denne forbindelsen, er det ikke tilrådelig å referere til det når det gjelder det reneste faste stoffet, eller som en uorganisk forbindelse (reagens, råmateriale, etc.).
applikasjoner
Nøytraliseringsmiddel
Mg (OH)to Det skylder sin lave løselighet i vann det faktum at det er en utmerket surhetsnøytraliserende middel; Ellers ville det basisere mediet ved å tilveiebringe store konsentrasjoner av OH-ioner-, akkurat som andre baser gjør (sterke elektrolytter).
Dermed Mg (OH)to slipper knapt OH-, mens du reagerer med H-ioner3ELLER+ for å danne det vandige komplekset av magnesium, også nevnt ovenfor. Å være i stand til å nøytralisere surheten i vandige medier, er det ment for behandling av avløpsvann.
Det er også et tilsetningsstoff til mat, gjødsel og visse produkter for personlig hygiene, for eksempel tannkrem, da det reduserer surheten..
Antacida
Siden den er lett løselig i vann, kan den inntas uten å risikere effekten av OH-ionene- (skiller seg veldig lite ut som en svak elektrolytt).
Denne egenskapen, knyttet til underavsnittet over, gjør det til et syrenøytraliserende middel mot halsbrann, gastrointestinale sykdommer, fordøyelsesbesvær og forstoppelse, som selges under formelen magnesia melk..
På den annen side hjelper magnesia melk også med å bekjempe irriterende kreftsår (de hvite og røde sårene som dukker opp i munnen).
Brannhemmende
I eiendomsdelen ble det nevnt at Mg (OH)to nedbryter slippende vann. Nettopp dette vannet hjelper til med å stoppe flammenes fremskritt, siden de absorberer varme for å fordampe, og i sin tur fortyner dampene de brennbare eller brennbare gassene..
Brucittmineral brukes vanligvis industrielt til dette formålet, bestemt som fyllstoff i visse materialer, for eksempel plast av forskjellige polymerer (PVC, harpiks, gummi), kabler eller tak..
Katalysator
Mg (OH)to syntetisert som nanoplater, har det vist seg å være effektiv i å katalysere kjemiske reduksjoner; for eksempel den av 4-nitrofenol (Ph-NOto) til 4-aminofenol (Ph-NHto). De har også antibakteriell aktivitet, så den kan brukes som et terapeutisk middel..
Absorberende
Noen faste stoffer av Mg (OH)to de kan være ganske porøse, avhengig av tilberedningsmetoden. Derfor finner de applikasjon som adsorbenter.
I vandige løsninger kan de adsorbere (på overflatene) fargestoffmolekylene, og klargjøre vannet. For eksempel er de i stand til å adsorbere indigokarminfargestoffet som er tilstede i vannstrømmer..
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Magnesiumhydroksid. Gjenopprettet fra: en.wikipedia.org
- Nasjonalt senter for bioteknologisk informasjon. (2019). Magnesiumhydroksid. PubChem-database. CID = 14791. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Amethyst Galleries. (2014). Mineralbrucitten. Gjenopprettet fra: galleries.com
- Henrist et al. (2003). Morfologisk studie av magnesiumhydroksid nanopartikler
- utfelt i fortynnet vandig løsning. Journal of Crystal Growth 249, 321-330.
- Saba J., Shanza R. K., Muhammad R. S. (2018). Syntese og strukturanalyse av mesoporøse magnesiumhydroksid-nanopartikler som effektiv katalysator.
- Thimmasandra Narayan Ramesh og Vani Pavagada Sreenivasa. (2015). Fjerning av Indigo Carmine Dye fra vandig løsning ved bruk av magnesiumhydroksid som adsorberende middel. Journal of Materials, vol. 2015, artikkel-ID 753057, 10 sider. doi.org/10.1155/2015/753057



Ingen har kommentert denne artikkelen ennå.