
Avogadros lovlige måleenheter og eksperimenter
De Avogadros lov postulerer at et like volum av alle gasser, ved samme temperatur og trykk, har samme antall molekyler. Amadeo Avogadro, en italiensk fysiker, foreslo to hypoteser i 1811: den første sier at atomene til elementære gasser er sammen i molekyler i stedet for å eksistere som separate atomer, som John Dalton sa..
Den andre hypotesen sier at like volum gasser ved konstant trykk og temperatur har samme antall molekyler. Avogadros hypotese relatert til antall molekyler i gasser ble ikke akseptert før i 1858, da den italienske kjemikeren Stanislao Cannizaro bygde et logisk kjemisk system basert på dette.

Følgende kan trekkes ut av Avogadros lov: for en gitt masse av en ideell gass er volumet og antall molekyler direkte proporsjonale hvis temperaturen og trykket er konstant. Dette innebærer også at molarvolumet av gasser som oppfører seg ideelt, er det samme for alle.
For eksempel, gitt et antall ballonger, merket A til Å, blir de alle fylt til de blåses opp til et volum på 5 liter. Hver bokstav tilsvarer en annen gassform; det vil si at molekylene har sine egne egenskaper. Avogadros lov sier at alle ballonger huser like mange molekyler.
Hvis ballongene nå blåses opp til 10 liter, ifølge Avogadros hypoteser, vil dobbelt så mange innledende gassformer være innført.
Artikkelindeks
- 1 Hva den består av og måleenheter
- 1.1 Trekk av verdien av R når den uttrykkes i L atm / K mol
- 2 Vanlig form for Avogadros lov
- 3 Konsekvenser og implikasjoner
- 4 Opprinnelser
- 4.1 Avogadros hypotese
- 4.2 Avogadros nummer
- 5 Avogadros eksperiment
- 5.1 Eksperiment med kommersielle containere
- 6 Eksempler
- 6,1 O2 + 2H2 => 2H2O
- 6,2 N2 + 3H2 => 2NH3
- 6,3 N2 + O2 => 2NO
- 7 Referanser
Hva den består av og måleenheter
Avogadros lov sier at, for en masse av en ideell gass, er volumet av gass og antall mol direkte proporsjonale hvis temperaturen og trykket er konstant. Matematisk kan det uttrykkes med følgende ligning:
V / n = K
V = gassvolum, vanligvis uttrykt i liter.
n = mengden av stoffet målt i mol.
Også fra den såkalte idealgassloven har vi følgende:
PV = nRT
P = gasstrykk uttrykkes vanligvis i atmosfærer (atm), i mm kvikksølv (mmHg) eller i Pascal (Pa).
V = gassvolumet uttrykt i liter (L).
n = antall mol.
T = temperaturen på gassen uttrykt i grader Celsius, grader Fahrenheit eller grader Kelvin (0 ºC tilsvarer 273,15 K).
R = den universelle konstanten av ideelle gasser, som kan uttrykkes i forskjellige enheter, blant hvilke følgende skiller seg ut: 0,08205 L atm / K. mol (L atm K-1.muldvarp-1); 8,314 J / K. mol (J.K-1.muldvarp-1) (J er joule); og 1,987 cal / Kmol (cal.K-1.muldvarp-1) (kal er kalorier).
Trekk av verdien av R uttrykt i LMinibank / KMuldvarp
Volumet som et mol av en gass opptar ved en atmosfære av trykk og 0 ºC tilsvarende 273K er 22,414 liter.
R = PV / T
R = 1 atm x 22,414 (L / mol) / (273 ºK)
R = 0,082 L atm / mol.K
Den ideelle gassligningen (PV = nRT) kan skrives som følger:
V / n = RT / P
Hvis temperatur og trykk antas å være konstante, fordi R er en konstant, så:
RT / P = K
Seinere:
V / n = K
Dette er en konsekvens av Avogadros lov: eksistensen av et konstant forhold mellom volumet som en ideell gass opptar og antall mol av den gassen, for konstant temperatur og trykk..
Vanlig form for Avogadros lov
Hvis du har to gasser, blir ligningen ovenfor følgende:
V1/ n1= Vto/ nto
Dette uttrykket er også skrevet som:
V1/ Vto= n1/ nto
Ovennevnte viser det angitte forholdsmessige forholdet.
I hypotesen hans påpekte Avogadro at to ideelle gasser i samme volum og ved samme temperatur og trykk inneholder samme antall molekyler.
I forlengelse gjelder det samme for ekte gasser; for eksempel et like volum av Oto og Nto inneholder samme antall molekyler når den har samme temperatur og trykk.
Ekte gasser viser små avvik fra ideell oppførsel. Imidlertid er Avogadros lov omtrent gyldig for ekte gasser ved lavt nok trykk og ved høye temperaturer.
Konsekvenser og implikasjoner
Den viktigste konsekvensen av Avogadros lov er at konstant R for ideelle gasser har samme verdi for alle gasser.
R = PV / nT
Så hvis R er konstant for to gasser:
P1V1/ nT1= PtoVto/ ntoTto = konstant
Suffikser 1 og 2 representerer to forskjellige ideelle gasser. Konklusjonen er at den ideelle gasskonstanten for 1 mol gass er uavhengig av naturen til gassen. Så vil volumet som opptas av denne mengden gass ved en gitt temperatur og et trykk alltid være det samme.
En konsekvens av anvendelsen av Avogadros lov er funnet at 1 mol av en gass opptar et volum på 22.414 liter ved et trykk på 1 atmosfære og ved en temperatur på 0 ºC (273K).
En annen åpenbar konsekvens er følgende: Hvis trykk og temperatur er konstant, når mengden av en gass økes, vil volumet også øke..
opprinnelse
I 1811 la Avogadro frem sin hypotese basert på Daltons atomteori og Gay-Lussacs lov om molekylers bevegelsesvektorer..
Gay-Lussac konkluderte i 1809 at "gasser, uansett proporsjoner de kan kombineres, gir alltid opphav til forbindelser hvis elementer målt i volum alltid er multipler av en annen".
Den samme forfatteren viste også at "gasskombinasjoner alltid foregår etter veldig enkle volumforhold".
Avogadro påpekte at kjemiske reaksjoner i gassfasen involverer molekylære arter av både reaktanter og produkt.
I følge denne uttalelsen må forholdet mellom reaktanten og produktmolekylene være et helt tall, siden eksistensen av bindingsbrudd før reaksjonen (individuelle atomer) ikke er sannsynlig. Imidlertid kan molære mengder uttrykkes med brøkverdier.
Loven om kombinasjonsvolum indikerer på sin side at det numeriske forholdet mellom gassvolumene også er enkelt og heltall. Dette resulterer i en direkte sammenheng mellom volumene og antall molekyler i gassformene..
Avogadro-hypotese
Avogadro foreslo at gassmolekyler var diatomiske. Dette forklarte hvordan to volumer molekylært hydrogen kombineres med ett volum molekylært oksygen for å gi to volumer vann..
Videre foreslo Avogadro at hvis like volum gasser inneholdt det samme antall partikler, skulle forholdet mellom tettheten til gassene være lik forholdet mellom molekylmassene til disse partiklene..
Å dele d1 med d2 gir åpenbart opphav til kvotienten m1 / m2, siden volumet okkupert av gassformene er det samme for begge arter, og det blir kansellert:
d1 / d2 = (m1 / V) / (m2 / V)
d1 / d2 = m1 / m2
Avogadros nummer
En føflekk inneholder 6,022 x 102. 3 molekyler eller atomer. Denne figuren kalles Avogadros nummer, selv om det ikke var han som beregnet det. Jean Pierre, nobelprisvinner fra 1926, foretok tilsvarende målinger og foreslo navnet til ære for Avogadro.
Avogadros eksperiment
En veldig enkel demonstrasjon av Avogadros lov består i å plassere eddiksyre i en glassflaske og deretter tilsette natriumbikarbonat, lukke flaskens munn med en ballong som forhindrer at en gass kommer inn eller ut fra innsiden av flasken.
Eddiksyre reagerer med natriumbikarbonat og frigjør dermed COto. Gassen akkumuleres i ballongen og forårsaker oppblåsing. Teoretisk sett er volumet som ballongen når, proporsjonalt med antall CO-molekylerto, som det fremgår av Avogadros lov.
Imidlertid har dette eksperimentet en begrensning: ballongen er en elastisk kropp; derfor, når veggen strekker seg på grunn av akkumulering av COto, det genereres en kraft i dette som motarbeider dens distensjon og prøver å redusere volumet på ballongen.
Eksperimenter med kommersielle containere
Et annet illustrerende eksperiment med Avogadros lov presenteres med bruk av brusbokser og plastflasker..
Når det gjelder brusbokser, helles natron i den og deretter tilsettes en sitronsyreoppløsning. Forbindelsene reagerer med hverandre og gir frigjøring av CO-gassto, som akkumuleres inne i boksen.
Deretter tilsettes en konsentrert natriumhydroksydoppløsning, som har den funksjonen å "sekvestre" CO.to. Tilgang til innsiden av boksen lukkes deretter raskt ved hjelp av maskeringstape.
Etter en viss tid observeres det at boksen trekker seg sammen, noe som indikerer at tilstedeværelsen av CO har redusert.to. Deretter kan man tro at det er en reduksjon i volumet på boksen som tilsvarer en reduksjon i antall CO-molekyler.to, i henhold til Avogadros lov.
I eksperimentet med flasken følges den samme prosedyren som med brusboksen, og når NaOH tilsettes, lukkes munnen på flasken med lokket; på samme måte observeres en sammentrekning av flaskeveggen. Som et resultat kan den samme analysen utføres som i tilfelle brusboksen..
Eksempler
De tre bildene nedenfor illustrerer konseptet i Avogadros lov, som relaterer volumet som gassene okkuperer og antall molekyler av reaktanter og produkter..
ELLERto + 2Hto => 2HtoELLER
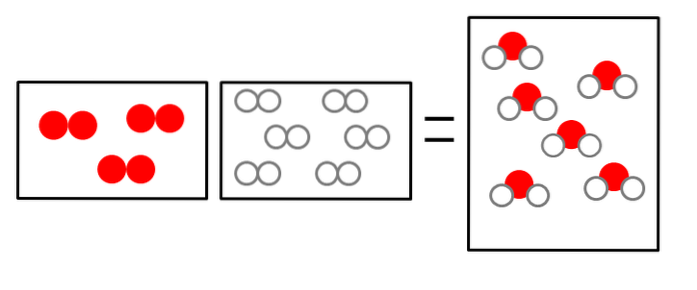
Volumet av hydrogengass er dobbelt, men det opptar en beholder av samme størrelse som gassformet oksygen.
Nto + 3Hto => 2NH3
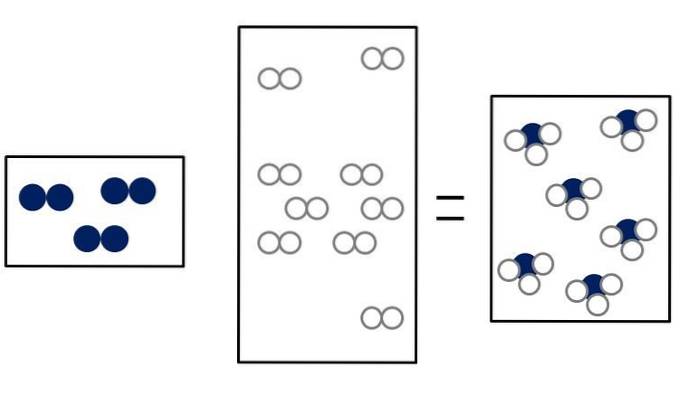
Nto + ELLERto => 2NO

Referanser
- Bernard Fernandez, PhD. (Februar 2009). To hypoteser om Avogadro (1811). [PDF]. Hentet fra: bibnum.education.fr
- Nuria Martínez Medina. (5. juli 2012). Avogadro, den store italienske forskeren på 1800-tallet. Hentet fra: rtve.es
- Muñoz R. og Bertomeu Sánchez J.R. (2003) Vitenskapens historie i lærebøker: Avogadros hypotese (r), Teaching science, 21 (1), 147-161.
- Helmenstine, Anne Marie, Ph.D. (1. februar 2018). Hva er Avogadros lov? Hentet fra: thoughtco.com
- Redaksjonen av Encyclopaedia Britannica. (2016, 26. oktober). Avogadros lov. Encyclopædia Britannica. Hentet fra: britannica.com
- Yang, S. P. (2002). Husholdningsprodukter som brukes til å kollapse, lukker containere og demonstrerer Avogadros lov. Kjemisk pedagog. Vol: 7, sider: 37-39.
- Glasstone, S. (1968). Traktaten om fysisk kjemi. togir Ed. Redaksjonelt Aguilar.
Ingen har kommentert denne artikkelen ennå.