
Lov om bevaring av materieeksperimenter og eksempler

De lov om bevaring av materie eller masse Det er en som fastslår at materie verken skapes eller ødelegges i en hvilken som helst kjemisk reaksjon. Denne loven er basert på det faktum at atomer er udelelige partikler i denne typen reaksjon; mens i atomreaksjoner fragmenterer atomer, og det er derfor kjemiske reaksjoner ikke blir vurdert.
Hvis atomene ikke blir ødelagt, må antallet atomer før og etter reaksjonen holdes konstant når et element eller en forbindelse reagerer; som oversettes til en konstant mengde masse mellom reaktantene og produktene som er involvert.
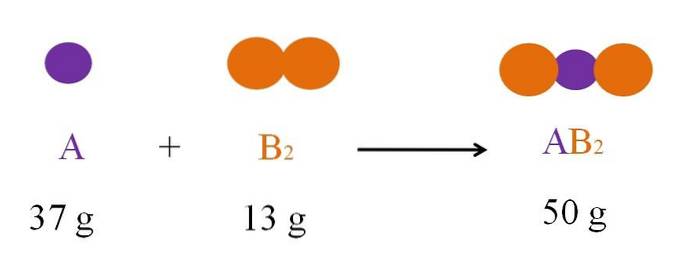
Dette er alltid tilfelle hvis det ikke er noen lekkasje som forårsaker tap av materiale; men hvis reaktoren er hermetisk lukket, forsvinner ingen atom, og derfor må den ladede massen være lik massen etter reaksjonen.
Hvis produktet er fast, derimot, vil massen være lik summen av reaktantene som er involvert i dannelsen. Det samme skjer med flytende eller gassformige produkter, men det er mer utsatt for å gjøre feil når de måler de resulterende massene..
Denne loven ble født fra eksperimenter i de siste århundrene, og ble styrket av bidrag fra forskjellige kjente kjemikere, som Antoine Lavoisier..
Tenk på reaksjonen mellom A og Bto å danne ABto (toppbilde). I henhold til loven om bevaring av materie, massen av ABto må være lik summen av massene A og B.to, henholdsvis. Så hvis 37g A reagerer med 13g Bto, produkt ABto må veie 50g.
Derfor, i en kjemisk ligning, massen av reaktantene (A og Bto) må alltid være lik produktets masse (ABto).
Et eksempel som er veldig likt det som nettopp er beskrevet, er dannelsen av metalloksider, for eksempel rust eller rust. Rust er tyngre enn jern (selv om det kanskje ikke virker som det) siden metallet reagerte med en masse oksygen for å generere oksidet.
Artikkelindeks
- 1 Hva er loven om bevaring av materie eller masse??
- 1.1 Lavoisiers bidrag
- 2 Hvordan brukes denne loven i en kjemisk ligning?
- 2.1 Grunnleggende prinsipper
- 2.2 Kjemisk ligning
- 3 Eksperimenter som viser loven
- 3.1 Forbrenning av metaller
- 3.2 Utslipp av oksygen
- 4 eksempler (praktiske øvelser)
- 4.1 Nedbrytning av kvikksølvmonoksid
- 4.2 Forbrenning av magnesiumbånd
- 4.3 Kalsiumhydroksid
- 4.4 Kobberoksid
- 4.5 Dannelse av natriumklorid
- 5 Referanser
Hva er loven om bevaring av materie eller masse??
Denne loven sier at i en kjemisk reaksjon er massen av reaktantene lik massen av produktene. Loven kommer til uttrykk i uttrykket "materie er verken skapt eller ødelagt, alt er forvandlet", slik det ble forutsatt av Julius Von Mayer (1814-1878).
Loven ble utviklet uavhengig av Mikhail Lamanosov, i 1745, og av Antoine Lavoisier i 1785. Selv om Lamanosovs forskning om loven om bevaring av masse gikk før Lavoisiers, var de ikke kjent i Europa for å være skrevet på russisk..
Eksperimentene utført i 1676 av Robert Boyle førte dem til å påpeke at når et materiale ble forbrennet i en åpen beholder, økte materialet i vekt; kanskje på grunn av en transformasjon som materialet selv opplever.
Lavoisers eksperimenter med forbrenning av materialer i containere med begrenset luftinntak viste en vektøkning. Dette resultatet var i samsvar med det som ble oppnådd av Boyle.
Lavoisiers bidrag
Lavoisiers konklusjon var imidlertid en annen. Han trodde at under forbrenningen ble det hentet ut en mengde masse fra luften, noe som ville forklare økningen i masse som ble observert i materialene som ble utsatt for forbrenning..
Lavoiser trodde at massen av metaller forble konstant under forbrenning, og at reduksjonen i forbrenning i lukkede beholdere ikke var forårsaket av en reduksjon i et løst (nedlagt konsept), en antatt essens knyttet til produksjon av varme..
Lavoiser påpekte at den observerte reduksjonen heller var forårsaket av en reduksjon i konsentrasjonen av gassene i de lukkede beholderne..
Hvordan brukes denne loven i en kjemisk ligning?
Loven om bevaring av masse er av transcendental betydning i støkiometri, sistnevnte blir definert som beregning av de kvantitative forholdene mellom reaktanter og produkter som er tilstede i en kjemisk reaksjon..
Prinsippene for støkiometri ble uttalt i 1792 av Jeremías Benjamin Richter (1762-1807), som definerte det som vitenskapen som måler de kvantitative proporsjonene eller masseforholdet til de kjemiske elementene som er involvert i en reaksjon..
I en kjemisk reaksjon er det en modifisering av stoffene som deltar i den. Det observeres at reaktantene eller reaktantene forbrukes for å stamme fra produktene.
Under den kjemiske reaksjonen er det brudd på bindinger mellom atomene, samt dannelse av nye bindinger; men antall atomer involvert i reaksjonen forblir uendret. Dette er det som er kjent som loven om bevaring av materie.
Grunnleggende prinsipper
Denne loven innebærer to grunnleggende prinsipper:
-Det totale antallet atomer av hver type er lik i reaktantene (før reaksjonen) og i produktene (etter reaksjonen).
-Summen av elektriske ladninger før og etter reaksjonen forblir konstant.
Dette er fordi antallet subatomære partikler forblir konstant. Disse partiklene er nøytroner uten elektrisk ladning, positivt ladede protoner (+) og negativt ladede elektroner (-). Så den elektriske ladningen endres ikke under en reaksjon.
Kjemisk ligning
Når det er sagt ovenfor, må de grunnleggende prinsippene respekteres når de representerer en kjemisk reaksjon gjennom en ligning (som den i hovedbildet). Den kjemiske ligningen bruker symboler eller representasjoner av de forskjellige elementene eller atomene, og hvordan de grupperes i molekyler før eller etter reaksjonen.
Følgende ligning vil bli brukt igjen som et eksempel:
A + B.to => ABto
Abonnementet er et tall som er plassert på høyre side av elementene (Bto og ABto) i nedre del, som indikerer antall atomer til et element som er tilstede i et molekyl. Dette tallet kan ikke endres uten produksjon av et nytt molekyl, forskjellig fra det opprinnelige..
Den støkiometriske koeffisienten (1, for A og resten av arten) er et tall som er plassert på venstre side av atomene eller molekylene, noe som indikerer antall av dem som er involvert i en reaksjon.
I en kjemisk ligning, hvis reaksjonen er irreversibel, plasseres en enkelt pil som indikerer reaksjonsretningen. Hvis reaksjonen er reversibel, er det to piler i motsatt retning. Til venstre for pilene er reagensene eller reaktantene (A og B.to), mens til høyre er produktene (ABto).
Svingende
Å balansere en kjemisk ligning er en prosedyre som gjør det mulig å tilsvare antall atomer av de kjemiske elementene i reaktantene med produktene.
Med andre ord må antall atomer til hvert element være det samme på reaktantsiden (før pilen) og på reaksjonsprodukten (etter pilen).
Det sies at når en reaksjon er balansert, respekteres loven om masseaksjon.
Derfor er det viktig å balansere antall atomer og elektriske ladninger på begge sider av pilen i en kjemisk ligning. Likeledes må summen av massene av reaktantene være lik summen av massene av produktene.
Når det gjelder den representerte ligningen, er den allerede balansert (likt antall A og B på begge sider av pilen).
Eksperimenter som beviser loven
Metallforbrenning
Lavoiser, som observerte forbrenningen av metaller som bly og tinn i lukkede beholdere med et begrenset luftinntak, la merke til at metallene var dekket med en kalsinering; og dessuten at vekten av metallet på et gitt tidspunkt for oppvarming var lik begynnelsen.
Ettersom en vektøkning observeres når man forbrenner et metall, mente Lavoiser at den observerte overvekten kunne forklares med en viss masse av noe som fjernes fra luften under forbrenning. Av denne grunn forble massen konstant.
Denne konklusjonen, som kan betraktes med et usunt vitenskapelig grunnlag, er ikke slik, med tanke på kunnskapen som Lavoiser hadde om eksistensen av oksygen på det tidspunktet han fortalte sin lov (1785).
Utslipp av oksygen
Oksygen ble oppdaget av Carl Willhelm Scheele i 1772. Senere oppdaget Joseph Priesley det uavhengig, og publiserte resultatene av sin forskning, tre år før Scheele publiserte sine resultater på den samme gassen..
Priesley oppvarmet kvikksølvmonoksid og samlet en gass som økte flammens lysstyrke. I tillegg, når musene ble plassert i en beholder med gassen, ble de mer aktive. Priesley kalte dette dephlogisticized gass.
Priesley rapporterte sine observasjoner til Antoine Lavoiser (1775), som gjentok sine eksperimenter som viste at gass ble funnet i luft og i vann. Lavoiser anerkjente gass som et nytt element og ga den navnet oksygen.
Da Lavoisier brukte som et argument for å si sin lov, at overflødig masse som ble observert i forbrenning av metaller skyldtes noe som ble hentet ut av luften, tenkte han på oksygen, et element som kombineres med metaller under forbrenning..
Eksempler (praktiske øvelser)
Nedbrytning av kvikksølvmonoksid
Hvis 232,6 kvikksølvmonoksid (HgO) varmes opp, spaltes det i kvikksølv (Hg) og molekylært oksygen (Oto). Basert på loven om bevaring av masse og atomvekter: (Hg = 206,6 g / mol) og (O = 16 g / mol), oppgi massen til Hg og Oto som er dannet.
HgO => Hg + Oto
232,6 g 206,6 g 32 g
Beregningene er veldig enkle, siden nøyaktig en mol HgO blir spaltet.
Forbrenning av magnesiumbelte

Et 1,2 g magnesiumbånd ble forbrennet i en lukket beholder inneholdende 4 g oksygen. Etter reaksjonen gjensto 3,2 g uomsatt oksygen. Hvor mye magnesiumoksid ble dannet?
Den første tingen å beregne er oksygenmassen som reagerte. Dette kan enkelt beregnes ved hjelp av en subtraksjon:
Masse av Oto som reagerte = startmasse av Oto - sluttmasse av Oto
(4 - 3,2) g Oto
0,8 g Oto
Basert på loven om bevaring av masse kan massen av dannet MgO beregnes.
Masse av MgO = masse av Mg + masse av O
1,2 g + 0,8 g
2,0 g MgO
Kalsiumhydroksid
En masse på 14 g kalsiumoksyd (CaO) reagerte med 3,6 g vann (HtoO), som ble fullstendig konsumert i reaksjonen for å danne 14,8 g kalsiumhydroksid, Ca (OH)to:
Hvor mye kalsiumoksyd reagerte for å danne kalsiumhydroksid?
Hvor mye kalsiumoksid som var igjen?
Reaksjonen kan skisseres av følgende ligning:
CaO + HtoO => Ca (OH)to
Ligningen er balansert. Derfor overholder den loven om bevaring av masse.
Masse av CaO involvert i reaksjonen = masse av Ca (OH)to - masse av HtoELLER
14,8 g - 3,6 g
11,2 g CaO
Derfor beregnes CaO som ikke reagerte (den som er til overs) ved å gjøre en subtraksjon:
Masse av overskudd av CaO = masse tilstede i reaksjonen - masse som deltok i reaksjonen.
14 g CaO - 11,2 g CaO
2,8 g CaO
Kobberoksid
Hvor mye kobberoksid (CuO) blir dannet når 11 g kobber (Cu) reagerer fullstendig med oksygen (Oto)? Hvor mye oksygen som trengs i reaksjonen?
Det første trinnet er å balansere ligningen. Den balanserte ligningen er som følger:
2Cu + Oto => 2CuO
Ligningen er balansert, så den er i samsvar med loven om bevaring av masse.
Atomvekten til Cu er 63,5 g / mol, og molekylvekten til CuO er 79,5 g / mol..
Det er nødvendig å bestemme hvor mye CuO som dannes fra fullstendig oksidasjon av 11 g Cu:
CuO masse = (11 g Cu) ∙ (1 mol Cu / 63,5 g Cu) ∙ (2 mol CuO / 2 mol Cu) ∙ (79,5 g CuO / mol CuO)
Masse av dannet CuO = 13,77 g
Derfor gir forskjellen i massene mellom CuO og Cu mengden oksygen involvert i reaksjonen:
Masse oksygen = 13,77 g - 11 g
1,77 g Oto
Dannelse av natriumklorid
En klormasse (Clto2,47 g ble omsatt med tilstrekkelig natrium (Na) og 3,82 g natriumklorid (NaCl) ble dannet. Hvor mye Na reagerte?
Balansert ligning:
2Na + Clto => 2NaCl
I henhold til loven om bevaring av masse:
Masse av Na = masse av NaCl - masse Clto
3,82 g - 2,47 g
1,35 g Na
Referanser
- Flores, J. Química (2002). Redaksjonell Santillana.
- Wikipedia. (2018). Lov om bevaring av materie. Gjenopprettet fra: es.wikipedia.org
- Nasjonalt polyteknisk institutt. (s.f.). Lov om bevaring av masse. CGFIE. Gjenopprettet fra: aev.cgfie.ipn.mx
- Helmenstine, Anne Marie, Ph.D. (18. januar 2019). Law of Conservation of Mass. Gjenopprettet fra: thoughtco.com
- Shrestha B. (18. november 2018). Loven om bevaring av materie. Kjemi LibreTexts. Gjenopprettet fra: chem.libretexts.org



Ingen har kommentert denne artikkelen ennå.