
Ritchter-Wenzel lovhistorier, uttalelser og eksempler

De Ritchter-Wenzel-lov eller av de gjensidige proporsjoner er en som fastslår at masseforholdene mellom to forbindelser gjør det mulig å bestemme den for en tredje forbindelse. Det er en av støkiometriens lover, sammen med Lavoisiers lov (lov om bevaring av masse); Prousts lov (lov av bestemte proporsjoner); og Daltons lov (lov av flere proporsjoner).
Ritcher fortalte sin lov i 1792 i en bok som definerte grunnleggende støkiometri, basert på forskningsarbeidene til Carl F Wenzel, som i 1777 publiserte den første ekvivalensbordet for syrer og baser..
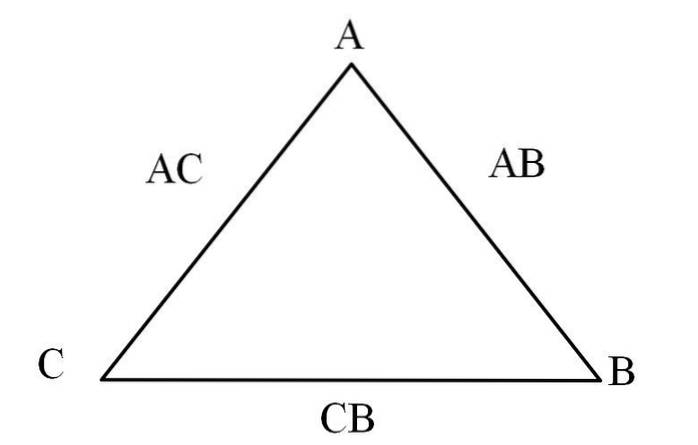
En enkel måte å visualisere det på er gjennom en "trekant av gjensidighet" (bildet ovenfor). Hvis du kjenner til massene A, C og B som blandes for å danne forbindelser AC og AB, kan du bestemme hvor mye av C og B som blandes eller reagerer for å danne forbindelse CB.
I forbindelser AC og AB er element A tilstede i begge, så ved å dele deres masseproporsjoner vil du finne ut hvor mye C reagerer med B.
Artikkelindeks
- 1 Historie og allmenngjøring av loven av gjensidige proporsjoner
- 2 Uttalelser og konsekvenser
- 3 eksempler
- 3.1 Kalsiumklorid
- 3.2 Svoveloksider
- 3.3 Jernsulfid og oksid
- 4 Referanser
Historie og allmenheter i loven om gjensidige proporsjoner
Richter fant at vektforholdet til forbindelsene som forbrukes i en kjemisk reaksjon alltid er det samme.
I denne forbindelse fant Ritcher at det kreves 615 vektdeler magnesia (MgO), for eksempel for å nøytralisere 1000 vektdeler svovelsyre.
Mellom 1792 og 1794 publiserte Ritcher et sammendrag på tre bind som inneholder sitt arbeid om loven med bestemte proporsjoner. Abstraktet handlet om støkiometri, og definerte det som kunsten å kjemiske målinger..
Merk oss videre at støkiometri omhandler lovene der stoffene forenes for å danne forbindelser. Richters forskningsarbeid ble imidlertid kritisert for den matematiske behandlingen han brukte, og det ble til og med påpekt at han justerte resultatene.
I 1802 publiserte Ernst Gottfried Fischer den første tabellen med kjemiske ekvivalenter, som brukte svovelsyre med tallet 1000; lik verdien funnet av Richter, for nøytralisering av svovelsyre med magnesia.
Imidlertid er det bemerket at Richter konstruerte en tabell over kombinasjonsvekter som indikerte hastigheten med hvilken et antall forbindelser reagerte. For eksempel er det anført at 859 deler NaOH nøytraliserer 712 deler HNO3.
Uttalelser og konsekvenser
Uttalelsen fra Richter-Wenzel-loven er følgende: massene av to forskjellige elementer som er kombinert med samme mengde av et tredje element, holder samme forhold som massene til disse elementene når de kombineres med hverandre..
Denne loven tillot å etablere ekvivalent vekt, eller vekt-ekvivalent gram, som mengden av et grunnstoff eller en forbindelse som vil reagere med en fast mengde av et referansestoff.
Richter kalte kombinasjonsvekt i forhold til vektene til elementene som kombineres med hvert gram hydrogen. De relative kombinasjonsvektene til Richter tilsvarer det som i dag er kjent som ekvivalentvekten til elementene eller forbindelsene.
I samsvar med den forrige tilnærmingen kan Richter-Wenzel-loven uttales som følger:
Kombinasjonsvektene til forskjellige elementer som er kombinert med en gitt vekt av et gitt element er den relative kombinasjonsvekten til disse elementene når de kombineres med hverandre, eller multipler eller delmultipler av disse størrelsesforholdene.
Eksempler
Kalsiumklorid
I kalsiumoksid (CaO) kombineres 40 g kalsium med 16 g oksygen (O). I mellomtiden, i hypokloroksid (CltoO), 71 g klor kombineres med 16 g oksygen. Hvilken forbindelse vil kalsium produsere hvis den kombineres med klor?
Ved å bruke gjensidighetstrekanten er oksygen det vanlige elementet for de to forbindelsene. Masseforholdene til de to oksygenatene blir først bestemt:
40 g Ca / 16 gO = 5 g Ca / 2 g O
71 g Cl / 16 g O
Og nå deler vi de to masseforholdene CaO og CltoEllers vil vi ha:
(5 g Ca / 2 g O) / (71 g Cl / 16 g O) = 80 g Ca / 142 g Cl = 40 g Ca / 71 g Cl
Merk at loven om masseforhold er oppfylt: 40 g kalsium reagerer med 71 g klor.
Svoveloksider
Oksygen og svovel reagerer med kobber for å gi henholdsvis kobberoksid (CuO) og kobbersulfid (CuS). Hvor mye svovel vil reagere med oksygen?
I kobberoksid kombineres 63,5 g kobber med 16 g oksygen. I kobbersulfid binder 63,5 g kobber til 32 g svovel. Fordeling av masseforholdene vi har:
(63,5 g Cu / 16 g O) / (63,5 g Cu / 32 g S) = 2032 g S / 1016 g O = 2 g S / 1 g O
Masseforholdet 2: 1 er et multiplum av 4 (63,5 / 16), som viser at Richters lov er sann. Med denne andelen oppnås SO, svovelmonoksid (32 g svovel reagerer med 16 g oksygen).
Hvis du deler dette forholdet med to, får du 1: 1. Igjen er det nå et multiplum av 4 eller 2, og derfor handler det om SOto, svoveldioksid (32 g svovel reagerer med 32 g oksygen).
Jernsulfid og oksid
Jernsulfid (FeS), hvor 32 g svovel kombineres med 56 g jern, reageres med jernoksid (FeO), hvor 16 g oksygen kombineres med 56 g jern. Denne varen fungerer som referanse.
I de reagerende forbindelsene FeS og FeO finnes svovel (S) og oksygen (O) i forhold til jern (Fe) i forholdet 2: 1. I svoveloksid (SO) kombineres 32 g svovel med 16 g oksygen, slik at svovel og oksygen er i forholdet 2: 1.
Dette indikerer at loven om gjensidige proporsjoner eller Richters lov er oppfylt.
Forholdet mellom svovel og oksygen i svoveloksid (2: 1), kan for eksempel brukes til å beregne hvor mye oksygen som reagerer med 15 g svovel.
g oksygen = (15 g S) ∙ (1 g O / 2 g S) = 7,5 g
Referanser
- Foist L. (2019). Loven om gjensidig andel: definisjon og eksempler. Studere. Gjenopprettet fra: study.com
- Cyber-oppgaver. (2016, 9. februar). Lov om gjensidige proporsjoner eller Richter-Wenzel. Gjenopprettet fra: cibertareas.infol
- Wikipedia. (2018). Lov om gjensidige proporsjoner. Gjenopprettet fra: en.wikipedia.org
- J.R. Partington M.B.E. D.Sc. (1953) Jeremias Benjamin Richter og loven om gjensidige proporsjoner.-II, Annals of Science, 9: 4, 289-314, DOI: 10.1080 / 00033795300200233
- Shrestha B. (18. juni 2015). Lov om gjensidige proporsjoner. Kjemi Libretexts. Gjenopprettet fra: chem.libretexts.org
- Omdefinere kunnskap. (29. juli 2017). Lov om gjensidige proporsjoner. Gjenopprettet fra: hemantmore.org.in



Ingen har kommentert denne artikkelen ennå.