
Karakteristiske mikrofilamenter, struktur, funksjoner, patologi
De mikrofilamenter eller aktinfilamenter, er en av de tre grunnleggende komponentene i cytoskelettet til eukaryote celler (mikrofilamenter, mikrotubuli og mellomfilamenter) og består av små filamenter av et protein som kalles aktin (aktinpolymerer).
I eukaryoter er genene som koder for aktinmikrofilamenter sterkt konserverte i alle organismer, og det er derfor de ofte brukes som molekylære markører for studier av forskjellige slag.

Mikrofilamenter distribueres i hele cytosolen, men er spesielt rikelig i regionen som ligger bak plasmamembranen, hvor de danner et komplekst nettverk og assosierer seg med andre spesielle proteiner for å danne cytoskelettet..
Mikrofilamentnettverk i cytoplasmaet til pattedyrceller er kodet av to av de seks gener som er beskrevet for aktin, som er involvert i mikrofilamentdynamikk og som til og med er veldig viktige under stamcelledifferensiering.
Mange forfattere er enige om at mikrofilamenter er de mest varierte, allsidige og viktige proteinene i cytoskelettet til de fleste eukaryote celler, og det er viktig å huske at disse ikke finnes i prokaryote mikroorganismer..
I denne typen celler er det derimot filamenter som er homologe med mikrofilamenter, men som består av et annet protein: MreB-proteinet..
For tiden antas genet som koder for dette proteinet å være et mulig forfedren for eukaryotisk aktin. Sekvenshomologien til aminosyrene som utgjør MreB-proteinet er imidlertid bare 15% med hensyn til aktinsekvensen.
Ettersom de er en grunnleggende del av cytoskelettet, kan enhver fenotypisk defekt i både mikrotubuli og mellomfilamenter og aktinmikrofilamenter (cytoskelett) forårsake forskjellige cellulære og systemiske patologier.
Artikkelindeks
- 1 Egenskaper og struktur
- 1.1 Organisasjon
- 2 Hvordan dannes aktinfilamenter?
- 2.1 Regulering
- 3 funksjoner
- 3.1 Eksempel på funksjoner i leveren
- 4 Relaterte patologier
- 5 Referanser
Kjennetegn og struktur
Mikrofilamenter består av proteinmonomerer av aktinfamilien, som er svært rikelig kontraktile proteiner i eukaryote celler, siden de også deltar i muskelsammentrekning..
Disse filamentene har en diameter mellom 5 og 7 nm, så de er også kjent som tynne filamenter og består av to former for aktin: kuleformen (G-aktin) og den trådformede formen (F-aktin)..
Proteinene som deltar i cytoskelettet er kjent som γ og β aktiner, mens de som deltar i sammentrekning vanligvis er α aktiner..
Andelen globulært aktin og trådformet aktin i cytosolen avhenger av cellulære behov, siden mikrofilamenter er svært variable og allsidige strukturer, som stadig vokser og forkorter ved polymerisering og depolymerisering..
G-aktin er et lite kuleprotein, bestående av nesten 400 aminosyrer og med en molekylvekt på rundt 43 kDa.
G-aktin-monomerer som utgjør mikrofilamentene er ordnet i form av en spiralformet streng, siden hver gjennomgår en vri når de er assosiert med den neste.
G-actin assosieres med ett molekyl av Ca2 + og et annet av ATP, som stabiliserer dets kuleform; mens F-aktin oppnås etter hydrolyse av terminal fosfat av ATP-molekylet til G-aktin, noe som bidrar til polymerisering.
Organisasjon
Aktinfilamenter kan organiseres i "bunter" eller "nettverk" som har forskjellige funksjoner i celler. Buntene danner parallelle strukturer forbundet med ganske stive kryssbroer.
Nettverk er derimot løsere strukturer, som tredimensjonale masker med egenskapene til halvfaste geler..
Det er mange proteiner som er assosiert med aktinfilamenter eller mikrofilamenter og er kjent som ABP (fra engelsk aktinbindende proteiner), som har spesifikke nettsteder for det.
Mange av disse proteinene tillater mikrofilamenter å samhandle med de to andre komponentene i cytoskelettet: mikrotubuli og mellomfilamenter, så vel som med de andre komponentene i plasmamembranen..
Andre proteiner som mikrofilamenter samhandler med inkluderer kjernelaminat og spektrin (i røde blodlegemer).
Hvordan dannes aktinfilamenter?
Siden kuleformede aktinmonomerer alltid binder på samme måte, orientert i samme retning, har mikrofilamenter en definert polaritet, med to ender: en "mer" og en "mindre"..
Polariteten til disse filamentene er veldig viktig, siden de vokser betydelig raskere i sin positive ende, der de nye G-aktinmonomerene tilsettes..

Det første som finner sted under polymerisasjonen av aktinfilamenter er en prosess kjent som "kimdannelse", som består av assosiasjonen av tre monomerer av proteinet.
Nye monomerer tilsettes denne trimeren i begge ender, slik at filamentet vokser. G-aktinmonomerer er i stand til å hydrolysere ATP med hver binding, noe som har implikasjoner for polymeriseringshastigheten, siden actin-ATP-deler dissosierer med større vanskeligheter enn actin-ADP-deler..
ATP er ikke nødvendig for polymerisering, og den spesifikke rollen til hydrolysen av den er ennå ikke belyst..
Noen forfattere mener at siden aktinpolymerisasjonshendelser er raskt reversible, kan ATP assosiert med disse prosessene representere opptil 40% av den totale cellulære omsetningen til dette energimolekylet..
Regulering
Både polymerisasjonen av aktinfilamenter og deres depolymerisering er prosesser som er sterkt regulert av en serie spesifikke proteiner, som er ansvarlige for ombygging av filamentene..
Et eksempel på proteiner som regulerer depolymerisering er aktindepolymerisasjonsfaktoren cofilin. Et annet protein, profilin, har en motsatt funksjon, siden det stimulerer assosiasjonen av monomerer (ved å stimulere utvekslingen av ADP mot ATP).
Funksjoner
Mikrofilamenter samhandler med myosinfilamenter som er assosiert med transmembranproteiner som har et domene i cytosolen og et annet i celleutvendig, og deltar dermed i prosessene med cellemobilitet.
Disse mikrofilamentene assosiert med plasmamembranen formidler forskjellige cellulære responser på forskjellige klasser av stimuli. For eksempel er celleadhesjon i epitelvev drevet av transmembrane proteiner kjent som kadheriner, som samhandler med mikrofilamenter for å rekruttere responsfaktorer..
Aktinfilamenter samhandler med mellomfilamenter for å føre til at ekstracellulære stimuli overføres til viktige steder som ribosomer og kromosomer i kjernen..
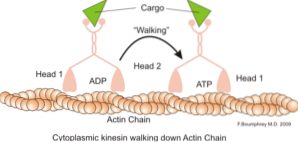
En klassisk og mye studert funksjon av mikrofilamenter er deres evne til å danne "broer", "skinner" eller "motorveier" for bevegelsen av motorproteinet myosin I, som er i stand til å laste transportvesikler fra organeller til membranen plasmatisk i sekretoriet. stier.
Mikrofilamenter samhandler også med myosin II for å etablere den kontraktile ringen som dannes under cytokinese, nettopp i løpet av den siste fasen av celledeling der cytosolen er atskilt fra stamceller og datterceller..
Generelt modulerer F-aktin-mikrofilamenter fordelingen av noen organeller som Golgi-komplekset, endoplasmatisk retikulum og mitokondrier. I tillegg deltar de også i romlig posisjonering av mRNA slik at de blir lest av ribosomer..
Hele det cellulære settet med mikrofilamenter, spesielt de som er nært beslektet med plasmamembranen, deltar i dannelsen av de bølgende membranene til celler som har en konstant aktiv bevegelse.
De er også involvert i dannelsen av mikrovilli og andre vanlige støt på overflaten til mange celler..
Eksempel på funksjoner i leveren
Mikrofilamenter deltar i gallsekresjonsprosessen i hepatocytter (leverceller) og også i peristaltiske bevegelser (koordinert sammentrekning) av leverkanaliculi.
De bidrar til differensiering av plasmamembrandomener takket være deres tilknytning til forskjellige cytosoliske elementer og kontrollen de utøver over topografien til disse intracellulære elementene..
Relaterte patologier
Det er få sykdommer assosiert med primære defekter i strukturen eller med regulatoriske proteiner og enzymer i syntesen av mikrofilamenter, til tross for at disse er direkte involvert i et stort antall funksjoner..
Den lave frekvensen av sykdommer og misdannelser i mikrofilamentens primære struktur skyldes at det generelt er flere gener som koder for både aktin og dets regulatoriske proteiner, et fenomen kjent som "genetisk redundans".
En av de mest studerte patologiene er forglassingen av oocyttene på deres cytoskjelett, hvor det blir observert et avbrudd i nettverket av kortikale mikrofilamenter, så vel som en depolymerisering og desorganisering av mikrotubuli i den mitotiske spindelen..
Generelt forårsaker denne forglassingen en kromosomal dispersjon, siden den fører til en forstyrrelse i komprimeringen av alt kromatinet.
Cellene som har større organisasjon og andel mikrofilamenter i cytoskjelettet er cellene i den stripete muskelen, derfor er de fleste patologier forbundet med en funksjonsfeil i kontraktilapparatet.
Defekte eller atypiske mikrofilamenter har også vært assosiert med beinsykdommen kjent som Pagets sykdom..
Referanser
- Aguilar-Cuenca, R., Llorente-González, C., Vicente, C., & Vicente-Manzanares, M. (2017). Mikrofilamentkoordinert vedheftingsdynamikk driver encellemigrasjon og former hele vev. F1000 Forskning, 6.
- Dos Remedios, C. G., Chhabra, D., Kekic, M., Dedova, I. V., Tsubakihara, M., Berry, D. A., & Nosworthy, N. J. (2003). Aktinbindende proteiner: regulering av cytoskjelettmikrofilamenter. Fysiologiske vurderinger, 83(2), 433-473.
- Guo, H., Fauci, L., Shelley, M., & Kanso, E. (2018). Bistabilitet i synkroniseringen av aktiverte mikrofilamenter. Journal of Fluid Mechanics, 836, 304-323.
- Lanza, R., Langer, R., & Vacanti, J. P. (red.). (2011). Prinsipper for vevsteknikk. Akademisk presse.
- Robbins, J. (2017). Sykdommer i cytoskelettet: Desminopatiene. I kardioskeletale myopatier hos barn og unge voksne (s. 173-192). Akademisk presse.

Ingen har kommentert denne artikkelen ennå.