
Karakteristiske myofibriller, struktur, sammensetning, funksjoner

De myofibriller De er strukturelle enheter av muskelceller, også kjent som muskelfibre. De er veldig rikelig, er ordnet parallelt og er innebygd av cytosolen til disse cellene.
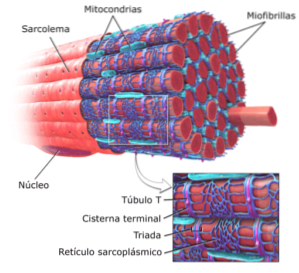
Strierte muskelceller eller fibre er veldig lange celler, som måler opptil 15 cm i lengde og fra 10 til 100 mikrometer i diameter. Dens plasmamembran er kjent som sarcolemma og dens cytosol som sarkoplasma..
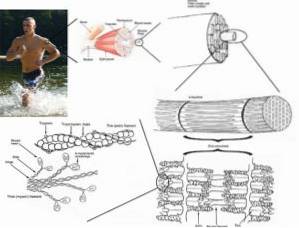
Innenfor disse cellene er, i tillegg til myofibriller, flere kjerner og mitokondrier som er kjent som sarkosomer, samt et fremtredende endoplasmatisk retikulum kjent som det sarkoplasmatiske retikulum.
Myofibriller er anerkjent som "kontraktile elementer" i muskler hos virveldyr. De er sammensatt av flere typer proteiner som gir dem elastiske og uttrekkbare egenskaper. I tillegg opptar de en viktig del av sarkoplasmen i muskelfibrene.
Artikkelindeks
- 1 Forskjeller mellom muskelfibre
- 2 Generelle egenskaper
- 2.1 Dannelse av myofibriller eller "myofibrillogenese"
- 3 Struktur og sammensetning
- 3.1 - Tynne myofilamenter
- 3.2 - Tykke myofilamenter
- 3.3 - Tilknyttede proteiner
- 4 funksjoner
- 5 Referanser
Forskjeller mellom muskelfibre
Det er to typer muskelfibre: strierte og glatte fibre, hver med en anatomisk fordeling og en spesifikk funksjon. Myofibriller er spesielt viktige og tydelige i de stripete muskelfibrene som utgjør skjelettmuskulaturen..
Strierte fibre presenterer et repeterende mønster av tverrbånd når de observeres under et mikroskop og er assosiert med skjelettmuskler og en del av hjertemuskulaturen..
Glatte fibre, derimot, presenterer ikke det samme mønsteret under mikroskopet og finnes i de karakteristiske musklene i vaskulaturen og fordøyelsessystemet (og alle innvoller).
Generelle egenskaper
Myofibriller består av to typer kontraktile filamenter (også kjent som myofilamenter), som igjen består av filamentformede proteiner myosin og actin, som vil bli beskrevet senere..
Ulike forskere har bestemt at halveringstiden til myofibrillene i kontraktile proteiner varierer fra 5 dager til 2 uker, slik at muskelen er et svært dynamisk vev, ikke bare fra det kontraktile synspunktet, men også fra syntesen og fornyelsen synspunkt. av dets strukturelle elementer.
Den funksjonelle enheten til hver myofibril i muskelceller eller fibre kalles en sarcomere og er avgrenset av en region kjent som "Z-båndet eller linjen", hvor aktin-myofilamentene i parallell rekkefølge strekker seg.
Siden myofibriller okkuperer en vesentlig del av sarkoplasmaet, begrenser disse fibrøse strukturene plasseringen av kjernene til cellene som de tilhører til periferien av cellene, nær sarkolemmaet..
Noen menneskelige patologier er relatert til forskyvningen av kjernene i myofibrillære bunter, og disse er kjent som sentro-nukleære myopatier.
Dannelse av myofibriller eller "myofibrillogenese"
De første myofibrillene samles under utviklingen av embryonal skjelettmuskulatur.
Proteinene som utgjør sarkomerer (de funksjonelle enhetene til myofibriller) er opprinnelig justert fra endene og sidene av "premiofibriller" som består av aktinfilamenter og små porsjoner av ikke-muskulært myosin II og spesifikt α-aktin av muskler..
Når dette skjer, uttrykkes genene som koder for hjerte- og skjelettisoformene til α-aktin i forskjellige proporsjoner i muskelfibre. Først er mengden kardiell isoform som uttrykkes større, og deretter endres dette mot skjelettet.
Etter dannelsen av premiofibriller, samler de fremvoksende myofibriller seg bak sonen av premiofibrildannelse, og i disse oppdages muskel myosin II-formen..
På dette punktet justeres myosinfilamentene og komplekseres med andre spesifikke myosinbindende proteiner, som også forekommer med aktinfilamenter..
Struktur og sammensetning
Som diskutert for et øyeblikk siden, består myofibriller av kontraktile proteinmyofilamenter: aktin og myosin, som også er kjent som henholdsvis tynne og tykke myofilamenter. Disse er synlige under lysmikroskopet.
- Tynne myofilamenter
De tynne filamentene til myofibrilene består av proteinaktinet i sin trådform (actin F), som er en polymer med kuleformen (actin G), som har en mindre størrelse.
De trådformede trådene av G-aktin (F-aktin) danner en dobbel streng som spoler til en helix. Hver av disse monomerene veier mer eller mindre 40 kDa og er i stand til å binde myosin på bestemte steder..
Disse filamentene er omtrent 7 nm i diameter og strekker seg mellom to områder kjent som bånd I og bånd A. I bånd A er disse filamentene lokalisert rundt de tykke filamentene og danner et sekundært sekskantet arrangement..
Spesielt er hvert tynt filament symmetrisk skilt fra tre tykke filamenter, og hvert tykt filament er omgitt av seks tynne filamenter.
Tynne og tykke filamenter samhandler med hverandre gjennom "tverrbroer" som stikker ut fra de tykke filamentene og vises i myofibrilstrukturen med jevne mellomrom på avstander nær 14 nm..
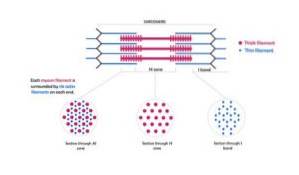
Aktinfilamentene og andre tilknyttede proteiner strekker seg utover "kantene" på Z-linjene og overlapper myosinfilamentene mot midten av hver sarkomer..
- Tykke myofilamenter
De tykke filamentene er polymerer av myosin II-proteinet (510 kDa hver) og er avgrenset av regioner kjent som "A-bånd".
Myosin myofilamenter er omtrent 16 nm lange og er ordnet i sekskantede arrangementer (hvis et tverrsnitt av en myofibril observeres).
Hver myosin II filament består av mange pakket myosinmolekyler, hver bestående av to polypeptidkjeder som har en klubbformet region eller "hode" og som er ordnet i "bunter" for å danne filamentene..
Begge buntene holdes over endene i midten av hver sarkomere, slik at "hodene" til hvert myosin er rettet mot Z-linjen, der de tynne filamentene er festet..
Myosinhodene oppfyller veldig viktige funksjoner, siden de har bindingssteder for ATP-molekyler, og i tillegg under muskelsammentrekning, er de i stand til å danne tverrbroer for å samhandle med de tynne aktinfilamentene.
- Tilknyttede proteiner
Aktinfilamenter er "forankret" eller "festet" til plasmamembranen til muskelfibre (sarcolemma) takket være deres interaksjon med et annet protein kjent som dystrofin.
I tillegg er det to viktige aktinbindende proteiner kjent som troponin og tropomyosin som sammen med aktinfilamenter danner et proteinkompleks. Begge proteinene er essensielle for reguleringen av interaksjonene som finner sted mellom tynne og tykke filamenter..
Tropomyosin er også et tostrenget trådformet molekyl som assosieres med aktinhelices spesielt i området av sporene mellom de to strengene. Troponin er et tredelt globulært proteinkompleks som er arrangert i intervaller på aktinfilamentene.
Dette siste komplekset fungerer som en kalsiumavhengig "bryter" som regulerer sammentrekningsprosessene til muskelfibre, og det er derfor det er av største betydning..
I den stribede muskelen hos virveldyr er det i tillegg to andre proteiner som samhandler med de tykke og tynne filamentene, kjent som henholdsvis titin og nebulin..
Nebulin har viktige funksjoner for å regulere lengden på aktinfilamenter, mens titin deltar i støtte og forankring av myosinfilamenter i en region av sarkomeren kjent som M-linjen..
Andre proteiner
Det er andre proteiner som er assosiert med de tykke myofilamentene som er kjent som myosin-bindende protein C og myomesin, som er ansvarlige for fiksering av myosinfilamenter i M-linjen..
Funksjoner
Myofibriller har grunnleggende implikasjoner for bevegelseskapasiteten til virveldyr.
Siden de utgjøres av de fibrøse og kontraktile proteinkompleksene i det muskulære apparatet, er disse viktige for å utføre responsene på nervøse stimuli som fører til bevegelse og forskyvning (i skjelettstrimmede muskler).
De ubestridelige dynamiske egenskapene til skjelettmuskulaturen, som utgjør mer enn 40% av kroppsvekten, er tildelt av myofibriller som samtidig har mellom 50 og 70% av proteinene i menneskekroppen..
Myofibriller, som en del av disse musklene, deltar i alle funksjonene:
- Mekanisk: å konvertere kjemisk energi til mekanisk energi for å generere kraft, opprettholde holdning, produsere bevegelser, etc..
- Metabolsk: siden muskelen deltar i den basale energimetabolismen og fungerer som et lagringssted for grunnleggende stoffer som aminosyrer og karbohydrater; Det bidrar også til produksjon av varme og forbruk av energi og oksygen som brukes under fysiske aktiviteter eller sportsøvelser.
Siden myofibriller hovedsakelig består av proteiner, representerer de et lagrings- og frigjøringssted for aminosyrer som bidrar til å opprettholde blodsukkernivået under faste eller sult..
Frigjøring av aminosyrer fra disse muskulære strukturer er også viktig med tanke på de biosyntetiske behovene til andre vev som hud, hjerne, hjerte og andre organer..
Referanser
- Despopoulos, A., & Silbernagl, S. (2003). Color Atlas of Physiology (5. utg.). New York: Thieme.
- Friedman, A. L., og Goldman, Y. E. (1996). Mekanisk karakterisering av myofibriller i skjelettmuskulatur. Biofysisk tidsskrift, 71(5), 2774-2785.
- Frontera, W. R., & Ochala, J. (2014). Skjelettmuskel: En kort gjennomgang av struktur og funksjon. Calcif Tissue Int, Fire fem(2), 183-195.
- Goldspink, G. (1970). Spredning av myofibriller under vekst av muskelfibre. J. Cell Sct., 6, 593-603.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harper's Illustrated Biochemistry (28. utg.). McGraw-Hill Medical.
- Rosen, J. N., & Baylies, M. K. (2017). Myofibriller legger press på kjerner. Naturcellebiologi, 19(10).
- Sanger, J., Wangs, J., Fan, Y., White, J., Mi-Mi, L., Dube, D., ... Pruyne, D. (2016). Montering og vedlikehold av myofibriller i Striated Muscle. I Håndbok for eksperimentell farmakologi (s. 37). New York, USA: Springer International Publishing Sveits.
- Sanger, J. W., Wang, J., Fan, Y., White, J., & Sanger, J. M. (2010). Montering og dynamikk av myofibriller. Tidsskrift for biomedisin og bioteknologi, 2010, 8.
- Sobieszek, A., & Bremel, R. (1975). Forberedelse og egenskaper av virveldyr glatt - muskel myofibriller og actomyosin. European Journal of Biochemistry, 55(1), 49-60.
- Villee, C., Walker, W., & Smith, F. (1963). Generell zoologi (2. utg.). London: W. B. Saunders Company.



Ingen har kommentert denne artikkelen ennå.