
Molaritetskonsentrasjon, enheter, beregning, øvelser
De molaritet er konsentrasjonen av en løsning uttrykt i mol oppløst stoff per liter oppløsning. Den forkortes som M og uttrykker et forhold mellom løsemassens masse og løsningsvolumet (m / v); men tradisjonelt uttrykkes dette forholdet som vekt til volum.
En mol er antall atomer eller molekyler som er inneholdt i atom- eller molekylvekten; Det uttrykkes i gram / mol. En føflekk tilsvarer 6,02 · 102. 3 atomer eller molekyler, kjent som Avogadros nummer.
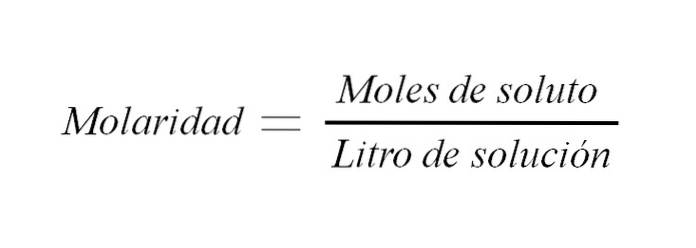
Det er andre måter å uttrykke forholdet mellom massen av en løsemiddel og volumet, inkludert: prosentforholdet mellom massen av løsemidlet og volumet av løsningen, og normalitet. Sistnevnte uttrykkes som antall ekvivalenter av en løsemiddel per liter løsning.
I mellomtiden uttrykker molalitet, som er definert som antall mol per kilo løsningsmiddel, vanligvis vann, et forhold mellom massen av løsemidlet og massen av løsningsmidlet (m / m)..
Formen for uttrykk for konsentrasjonen av en løsning i deler per million (ppm), uttrykker et forhold mellom en del av det oppløste stoffet og en million deler av løsningen, og blir vanligvis brukt til å uttrykke et massemasse-forhold (m / m) . Men du kan uttrykke et massevolumforhold (m / v).
Molekonsentrasjonen, i tillegg til å uttrykkes i mol per liter, kan uttrykkes som millimol / liter (millimolær løsning); mikromol / liter (mikromolær løsning); etc.
Molaritetsproblemer kan løses ved hjelp av en analytisk metode og ved å bruke "regelen om tre". Valget av metode vil avhenge av dyktigheten du har i bruken av en av metodene.
Artikkelindeks
- 1 Molar konsentrasjon
- 2 enheter
- 3 Hvordan beregne molaritet?
- 4 Gå fra molaritet til molalitet
- 4.1 Første trinn
- 4.2 Andre trinn
- 4.3 Tredje trinn
- 4.4 Fjerde trinn
- 4.5 Femte trinn
- 4.6 Numerisk eksempel
- 5 Problemer løst
- 5.1 Oppgave 1
- 5.2 Oppgave 2
- 5.3 Oppgave 3
- 5.4 Oppgave 4
- 5.5 Oppgave 5
- 6 Referanser
Molar konsentrasjon
Den brukes til å uttrykke konsentrasjonen av et løst stoff i et gitt løsningsvolum.
M = n / V (1)
Der M er lik molaritet, er n antall mol, og V er volumet av løsningen. Så molariteten til en løsning er antall mol oppløst stoff per volum oppløsning uttrykt i liter.
På den annen side er antall mol
n = m / PM (2)
Hvor m er massen av det oppløste oppløste stoffet og PM dets molare masse.
Erstatter (2) i (1):
M = (m / PM) / V.
Enheter
Enheten i det internasjonale systemet for molar konsentrasjon er mol / m3. Dette tilsvarer en millimolar løsning, fordi am3 tilsvarer 1000 liter. I grenene av kjemi og biologi uttrykkes molar konsentrasjon vanligvis som mol / L. Denne enheten er uttrykt med M (stor bokstav).
En løsning av en mol / L tilsvarer en løsning M; en løsning på 10-3 mol / L, tilsvarer 1 mM (millimolar); og en løsning på 10-6 mol / L, tilsvarer 1 µM (mikromolar).
Hvordan beregne molaritet?
Det er praktisk å bruke uttrykkene angitt ovenfor, fordi dette sikrer at resultatet av å bruke formelen vil gi i mol / liter, som er definisjonen av molar konsentrasjon.
For å beregne molariteten til en løsning, er det nødvendig å uttrykke konsentrasjonen av det oppløste stoffet i g / L. Finn deretter molekylvekten til det oppløste stoffet (g / mol) og finn forholdet mellom konsentrasjonen og molekylvekten. Det oppnådde resultatet er molariteten uttrykt i mol / liter.
Gå fra molaritet til molalitet
En nødvendig informasjon for å gå fra molaritet til molalitet er å kjenne tettheten til løsningen. Dette gjør det mulig å kjenne løsningsmassen, et viktig krav for å beregne molalitet..
Første skritt
Først må du gå fra molakonsentrasjonen til gram / liter. For å gjøre dette er det nok å multiplisere løsningenes molaritet med løsemidlets molekylvekt..
Gram / liter oppløst stoff = molaritet (mol / liter) · Molekylvekt av oppløst stoff (gram / mol).
Dette gjør det mulig å oppnå massen av det oppløste stoffet i 1 liter løsning.
Andre trinn
Da er det nødvendig å beregne løsningsmassen. For dette brukes tettheten av den. Vanligvis er tettheten uttrykt i gram / kubikkcentimeter eller milliliter.
Masse av løsningen (g) = volum av løsningen (ml) tetthet (g / ml)
Tredje trinn
Oppnå massen av løsningsmidlet. Siden massen av løsningen er lik massen av løsemidlet pluss massen av løsningsmidlet, er det nok å trekke massen av løsemidlet (trinn 1) fra massen av løsningen for å oppnå massen av det siste. steg 2)..
Fjerde trinn
Til slutt må den oppløste massen (g) av oppløsningen overføres til den oppløste massen som tilsvarer 1000 g eller 1 kg løsningsmiddel. For å gjøre dette ville det være nok å utføre en enkel regel med tre eller andre tilsvarende matematiske operasjoner.
Femte trinn
Del g oppløst stoff / 1000 g løsningsmiddel med molekylvekten til det oppløste stoffet (g / mol) for å oppnå molaliteten til løsningen.
Numerisk eksempel
En 3 M glukoseoppløsning (molekylvekt 180 g / mol) har en tetthet på 1,15 g / ml. Beregn molaliteten til denne løsningen.
Vi beregner først gram glukose oppløst i en liter løsning:
g / L = 3 mol / L 180 g / mol
= 540 g / l
Deretter beregner vi massen av løsningen ut fra dens tetthet:
g løsning (masse) = 1000 ml 1,15 g / ml
= 1150 g
Massen av løsemiddel er gitt av forskjellen:
Masse av løsemiddel = masse av løsning - masse av løsemiddel
= 1150 g - 540 g
= 610 g
Men 610 g er ikke 1000 g løsningsmiddel som definert av definisjonen av molalitet. Derfor må det beregnes hvor mange gram glukose som er oppløst i 1000 g løsningsmiddel:
Massen av løsemiddel = 540 g løsemiddel (1000 g løsemiddel / 610 g løsemiddel)
= 885,25 g
Og til slutt beregnes molaliteten ved å returnere gramene til mol:
Molalitet = (885,25 g oppløst stoff / 180 g / mol)
= 4,92 mol oppløst stoff / kg løsningsmiddel
= 4,92 m
Problemer løst
Oppgave 1
Hvor mye kobbersulfat skal til for å tilberede 500 ml av en 0,4 M løsning? Uttrykk resultatet i gram. Molekylvekt av kobbersulfat (CuSO4): 160 g / mol.
Vi bestemmer først molene som må oppløses i en slik løsning:
M = n / V.
n = M V
n = (0,4 mol / l) 0,5 l
= 0,2 mol
Å vite hvor mange mol koppersulfat dens masse kan oppnås
n = m / PM
m = nmolekylær vekt
m = 0,2 mol 160 g / mol
= 32 g CuSO4
Det vil si at 32 gram av dette saltet må oppløses i 500 ml oppløsningsmiddel.
Oppgave 2
Hvilket volum av en løsning er nødvendig for at når 0,4 mol oppløst stoff oppløses, har det en konsentrasjon på 0,25 M?
Volumet av løsningen er oppnådd fra begrepet molaritet
M = n / V.
V = n / M
V = 0,4 mol / (0,25 mol / L)
= 1,6 l
Det betyr at løsningen må ha et volum på 1,6 liter for å oppnå en slik konsentrasjon på 0,25 M.
Oppgave 3
En masse på 8 g natriumhydroksyd (NaOH) oppløses i 60 g av en løsning som har en tetthet på 1,6 g / ml. Hva blir molariteten til løsningen? Natriumhydroksydmolekylvekt: 40 g / mol.
Mol NaOH må først beregnes:
n = m / PM
= 8 g natriumhydroksid / (40 g / mol)
= 0,2 mol
Nå fortsetter vi med å beregne volumet av løsningen:
m = V d
v = 60 g / (1,6 g / ml)
v = 37,5 ml
For å oppnå molariteten må løsningsvolumet i liter plasseres:
V = 37,5 ml 10-3 L / ml
= 0,0375 L.
M = 0,2 mol / 0,0375 l
5,33 mol / l
5,33 M
Oppgave 4
Beregn molariteten til saltsyre (HCl) med en tetthet på 1,25 g / ml og en 35% konsentrasjon, uttrykt masse / masse. Saltsyremolekylvekt: 36,5 g / mol.
Bestem massen av 35% saltsyre
m = V d
m = 1000 ml 1,25 g / ml
= 1250 g
Men ikke alt er HCl, det er også vann:
masse HCl = 1250 g (35/100)
= 437,5 g
Noe som er det samme som å si at det i en liter 35% HC1-løsning er 437,5 gram HC1.
Deretter beregnes molene av HCl for umiddelbart å bestemme molariteten:
n = m / PM
n = (437,5 g / l) / (36,5 g / mol)
= 11,98 mol / l
Molaritet = 11,98 M
Oppgave 5
Beregn molariteten til en løsning som inneholder 5 g NaCl i 2 liter løsning. Molekylvekt av natriumklorid: 58,5 g / mol.
Mol / l NaCl kan oppnås i et enkelt trinn:
molaritet = (5 g NaCl / 2 L løsning) x (1 mol NaCl / 58,5 g NaCl)
= 0,043 mol / l
Molaritet = 0,043 M
En annen prosedyre kan være:
g / L NaCl = 5 g / 2 L
= 2,5 g / l
mol / L = (2,5 g / L) / (58,5 g / mol)
= 0,043 mol / l
= 0,043 M
Referanser
- Rodríguez, M. (2007). Kjemi. Salesian Editorial Foundation
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Wikipedia. (2019). Molaritet Gjenopprettet fra: es.wikipedia.org
- Atarés Huerta. (s.f.). Molaritet og molalitet. [PDF]. Gjenopprettet fra: riunet.upv.es
- Softchools. (2019). Molaritetsformel. Gjenopprettet fra: softschools.com


Ingen har kommentert denne artikkelen ennå.