
Peroxidases struktur, funksjoner og typer
De peroksidaser De er for det meste hemeproteiner med enzymatisk aktivitet som katalyserer oksydasjonen av et stort utvalg av organiske og uorganiske substrater ved bruk av hydrogenperoksid eller andre relaterte stoffer..
I bredeste forstand inkluderer begrepet "peroksidase" enzymer som NAD- og NADP-peroksidaser, fettsyreperoksidaser, cytokromperoksidaser, glutationperoksidaser og mange andre ikke-spesifikke enzymer..
Imidlertid er det mer vanlig å referere til uspesifikke enzymer fra forskjellige kilder som har oksidasoreduktaseaktivitet, og som bruker hydrogenperoksid og andre substrater for å katalysere deres oksidasjonsreduksjonsreaksjoner..
Heme peroxidases er ekstremt vanlig i naturen. Funnet i dyr, høyere planter, gjær, sopp og bakterier.
Hos pattedyr produseres disse av hvite blodlegemer, livmor, milt og lever, spyttkjertler, magevegger, lunger, skjoldbruskkjertler og annet vev..
I planter er plantearter som er rikest på peroksidaser, pepperrot og fikentrær. Peroksidase renset fra pepperrot har blitt grundig undersøkt og brukt til forskjellige formål innen eksperimentell biologi og biokjemi..
I eukaryote celler finnes disse viktige enzymene vanligvis i spesialiserte organeller kjent som "peroksisomer", som er omgitt av en enkelt membran og er involvert i mange cellulære metabolske prosesser..
Artikkelindeks
- 1 Struktur
- 2 funksjoner
- 2.1 Handlingsmekanisme
- 3 typer
- 3.1 -I henhold til kroppen
- 3.2 -I henhold til det aktive nettstedet
- 4 Referanser
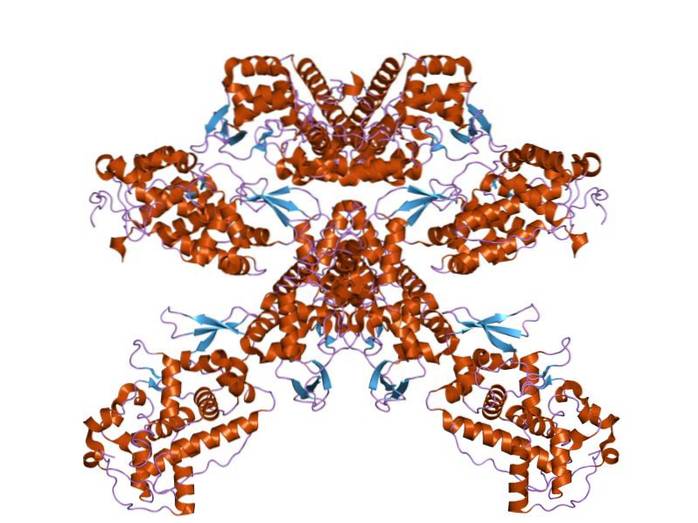
Struktur
Til tross for den lille homologien som eksisterer mellom de forskjellige klassene av peroksidaser, har det blitt bestemt at deres sekundære struktur og måten den er organisert på er ganske bevart blant de forskjellige artene.
Det er noen unntak, men de fleste peroksidaser er glykoproteiner, og karbohydrater antas å bidra til stabiliteten ved forhøyede temperaturer..
Disse proteinene har molekylvekter fra 35 til 150 kDa, som tilsvarer omtrent 250 og 730 aminosyrerester..
Med unntak av myeloperoksidase, inneholder alle molekyler av denne typen i sin struktur en hemgruppe som i hviletilstand har et jernatom i Fe + 3 oksidasjonstilstand. Planter har en protesegruppe kjent som ferroporfyrin XI.
Peroksidaser har to strukturelle domener som "omgir" hemgruppen, og hvert av disse domenene er produktet av uttrykket av et gen som gjennomgikk en dupliseringshendelse. Disse strukturene er sammensatt av mer enn 10 alfa-spiraler koblet av polypeptidløkker og svinger..
Korrekt folding av molekylet ser ut til å avhenge av tilstedeværelsen av konserverte glycin- og prolinrester, samt en asparaginsyrerest og en argininrest som danner en saltbro mellom dem som forbinder begge strukturelle domener..
Funksjoner
Hovedfunksjonen til peroksidasenzymer er fjerning av hydrogenperoksid fra det cellulære miljøet, som kan produseres ved forskjellige mekanismer og som kan representere alvorlige trusler mot intracellulær stabilitet..
Imidlertid, i denne prosessen med fjerning av denne reaktive oksygenarten (der oksygen har en mellomliggende oksidasjonstilstand), bruker peroksidaser oksidasjonsevnen til dette stoffet for å oppfylle andre viktige funksjoner for metabolisme..
I planter er disse proteinene en viktig del av lignifikasjonsprosesser og forsvarsmekanismer i vev infisert med patogener eller som har fått fysisk skade..
I den vitenskapelige sammenhengen har det kommet nye bruksområder for peroksidaser, og disse inkluderer behandling av avløpsvann som inneholder fenolforbindelser, syntese av aromatiske forbindelser og fjerning av peroksid fra mat eller avfall..
I analytiske og diagnostiske termer er pepperrotperoksidase kanskje det mest brukte enzymet for fremstilling av konjugerte antistoffer som brukes til immunologiske absorpsjonstester som ELISA. "Enzymkoblet immunosorbentanalyse") og også for bestemmelse av forskjellige typer forbindelser.
Virkningsmekanismen
Den katalytiske prosessen med peroksidaser skjer gjennom sekvensielle trinn som begynner med interaksjonen mellom det aktive stedet av enzymet og hydrogenperoksid, som oksyderer jernatomet i hemgruppen og genererer en ustabil mellomforbindelse kjent som forbindelse I (CoI).
Det oksyderte proteinet (CoI) har da en hemgruppe med et jernatom som gikk fra oksidasjonstilstand III til tilstand IV og for denne prosessen ble hydrogenperoksid redusert til vann.
Forbindelse I er i stand til å oksidere et elektrondonersubstrat, danne en substratradikal og bli en ny kjemisk art kjent som forbindelse II (CoII), som deretter reduseres av et andre substratmolekyl, regenererer jern i tilstand III og produserer en annen radikal.
Typer
-I følge kroppen
Peroksidaser er gruppert i tre klasser avhengig av organismen der de finnes:
- Klasse I: intracellulære prokaryote peroksidaser.
- Klasse II: ekstracellulære soppperoksidaser.
- Klasse III: utskilles vegetabilske peroksidaser.
I motsetning til klasse I-proteiner har de i klasse II og III disulfidbroer bygd mellom cysteinrester i strukturene, noe som gir dem en betydelig større stivhet..
Klasse II og III proteiner skiller seg også fra klasse I ved at de generelt har glykosyleringer på overflaten..
-I følge det aktive nettstedet
Mekanisk sett kan peroksidaser også kategoriseres i henhold til naturen til atomene som finnes i deres katalytiske sentrum. På denne måten hemoperoksidaser (den vanligste), vanadium-haloperoksidaser og annet.
Hemoperoksidaser
Som allerede nevnt har disse peroksidasene en protesegruppe i sitt katalytiske sentrum, kjent som hemgruppen. Jernatomet på dette stedet er koordinert av fire bindinger med nitrogenatomer..
Vanadium-haloperoksidaser
I stedet for en hemgruppe har vanadium-haloperoksidaser vanadat som en protesegruppe. Disse enzymene har blitt isolert fra marine organismer og noen terrestriske sopp.
Vanadinet i denne gruppen koordineres av tre ikke-proteinoksygener, et nitrogen fra en histidinrest og et nitrogen fra en azidbinding..
Andre peroksidaser
Mange bakterielle haloperoksidaser som har andre protesegrupper enn hem eller vanadium er kategorisert i denne gruppen. I denne gruppen er det også glutationperoksidaser, som inneholder en seleno-cystein protesegruppe og noen enzymer som er i stand til å oksidere lignin..
Referanser
- Alberts, B., Dennis, B., Hopkin, K., Johnson, A., Lewis, J., Raff, M., ... Walter, P. (2004). Essensiell cellebiologi. Abingdon: Garland Science, Taylor & Francis Group.
- Banci, L. (1997). Strukturelle egenskaper av peroksidaser. Journal of Biotechnology, 53, 253-263.
- Deurzen, M. P. J. Van, Rantwijk, F. Van, og Sheldon, R. A. (1997). Selektive oksidasjoner katalysert av peroksidaser. Tetraeder, 53(39), 13183-13220.
- Dunford, H. B., og Stillman, J. S. (1976). Om funksjonen og virkningsmekanismen til peroksidaser. Koordinering kjemi anmeldelser, 19, 187-251.
- Hamid, M., & Rehman, K. (2009). Potensielle anvendelser av peroksidaser. Matkjemi, 115(4), 1177-1186.
- Rawn, J. D. (1998). Biokjemi. Burlington, Massachusetts: Neil Patterson Publishers.
- Stansfield, W. D., Colomé, J. S. og Cano, R. J. (2003). Molekylær og cellebiologi. (K. E. Cullen, red.). McGraw-Hill ebøker.

Ingen har kommentert denne artikkelen ennå.