
Kalsiumperoksyd (CaO2) egenskaper, risikoer og bruksområder
De kalsiumperoksid, også kjent som kalsiumdioksid, det er en kjemisk forbindelse med formelen CaOto. Det skjer med samspillet mellom oppløsningen av et salt eller kalsiumhydroksyd og natriumperoksyd med påfølgende krystallisering.
Kalsiumperoksyd produseres ved utfelling av oktahydratforbindelsen fra en vandig løsning, etterfulgt av dehydrering ved temperaturer over 100 ° C..
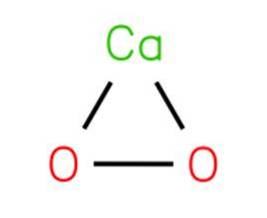
Kalsiumperoksid brytes ned for å frigjøre oksygen ved kontakt med hydratisert materiale. CaOto er et av de mest temperaturstabile uorganiske peroksidene og nedbrytes sakte i fuktig luft.
En vandig suspensjon på 1: 100 har en pH på ca. 12. Bortsett fra dens stabile oksygenfrigivende kapasitet, CaOto Den har lignende funksjoner til andre peroksider: bleking, desinfisering og deodorisering. Videre er det bemerkelsesverdig å merke seg at CaOto det er respektfullt med miljøet på grunn av dets egenskaper. (Kingsfield Inc, 2011).
Artikkelindeks
- 1 Fysiske og kjemiske egenskaper til kalsiumperoksid
- 2 Reaktivitet og farer
- 3 bruksområder
- 3.1 Bruk i jordsanering
- 3.2 Andre bruksområder
- 3.3 Miljøgjenoppretting
- 3.4 Industriell bruk
- 4 Referanser
Fysiske og kjemiske egenskaper til kalsiumperoksid
Kalsiumperoksid er et hvitt eller gulaktig pulver uten karakteristisk aroma eller smak (National Center for Biotechnology Information., 2017).

CaOto den har en molekylvekt på 72,0768 g / mol og en tetthet på 2,91 g / ml. Forbindelsen har et smeltepunkt på 200 ° C og nedbrytes over 355 ° C. Det er lett løselig i vann og danner hydrogenperoksid. Den har en pKa på 12,5 (Royal Society of Chemistry, 2015).
Kalsiumperoksid er en eksplosjonsfare hvis det blandes med finfordelt organisk materiale. Forbindelsen er ikke brennbar i seg selv, men akselererer heller forbrenningen av brennbart materiale. Dette skyldes at blandinger av brennbart materiale og peroksid kan antennes ved friksjon eller kontakt med fuktighet..
Reaktivitet og farer
Selv om det er en relativt stabil forbindelse sammenlignet med andre peroksider, er kalsiumperoksyd klassifisert som en eksplosiv forbindelse og et sterkt oksidasjonsmiddel..
Kontakt med kalsiumperoksid kan være sterkt irriterende og kan brenne huden og øynene. Eksponering kan irritere øyne, nese og hals.
Langvarig eksponering kan skade huden. Høyere nivåer av kalsiumperoksid kan irritere lungene og forårsake hoste eller kortpustethet..
Enda høyere eksponering kan føre til at væske samler seg i lungene (lungeødem), noe som fører til døden (National Library of Medicine, 2015).
I tilfelle kontakt med øynene, bør kontaktlinsene kontrolleres og fjernes. Vask deretter øynene umiddelbart med rikelig med kaldt vann i minst 15 minutter..
Ved hudkontakt skal det berørte området skylles straks med rikelig med vann i minst 15 minutter mens forurensede klær og sko fjernes. Dekk irritert hud med et mykgjørende middel. Vask klær og sko før de brukes på nytt. Hvis kontakten er alvorlig, vask med desinfiserende såpe og dekk forurenset hud med en antibakteriell krem..
Ved innånding skal offeret flyttes til et kjølig sted. Hvis du ikke puster, gis kunstig åndedrett.
Hvis stoffet svelges, fremkall brekninger med mindre medisinsk personell har instruert det. Det anbefales å drikke store mengder vann for å oppnå fortynning av forbindelsen. Tette klær som en skjortekrage, belte eller slips skal løsnes..
I alle tilfeller bør medisinsk hjelp innhentes umiddelbart (sikkerhetsdatablad kalsiumperoksid, 2013).
applikasjoner
Bruk i jordsanering
Av alle måtene du kan bruke kalsiumperoksid på, er landbruksapplikasjonen den mest utbredte. Det faktum at kalsiumperoksid frigjør oksygen ved kontakt med vann, betyr at det kan brukes som en måte å forynge utarmet jord på..
Normalt, etter intensivt jordbruk eller når jorden er oversvømmet, går næringsstoffer og oksygen tapt fra jorden, noe som gjør den steril..
I et slikt scenario må forskjellige kunstgjødsel brukes til å tilsette mineraler og næringsstoffer i jorden, i tillegg til andre inngrep for å gjøre den levedyktig igjen. Kalsiumperoksid er viktig for denne prosessen, da det brukes til å øke jordens oksygeninnhold.
Andre bruksområder
Det faktum at kalsiumperoksid kan frigjøre hydrogenperoksid når det kombineres med syrer, betyr at det kan brukes som blekemiddel..
Det er mye brukt på denne måten i mange papirindustrier. Produksjonen av hydrogenperoksid av denne forbindelsen gjør den også nyttig i deodorisering og bleking av hårprodukter så vel som tekstiler..
Kalsiumperoksid har også en plass i helsevesenet, da det kan brukes som et antiseptisk middel..
Kalsiumperoksid brukes i baking som et prosesseringshjelpemiddel ved blanding av brøddeig. Forbindelsen brytes ned i oksygen når den kommer i kontakt med vann. Dette oksyderer og styrker tverrbindinger av disulfid og ikke-disulfid i gluten..
Miljøgjenoppretting
Det faktum at kalsiumperoksid kan fungere som en oksygenkilde, betyr at det er nyttig i mange økologiske miljøer..
For eksempel er det mange vannmasser som innsjøer og dammer som har blitt lite levedyktige på grunn av forurensning og andre relaterte faktorer..
I et slikt scenario kan kalsiumperoksid også brukes til å forynge disse vannmassene. Oksygenet som frigjøres ved reaksjonen mellom vannet og forbindelsen, gjenoppretter oksygeninnholdet i vannet.
Industriell bruk
Kalsiumperoksyds rolle i produksjonen av plast er avgjørende for prosessene for katalyse og tverrbinding av de forskjellige forbindelsene som brukes i polymeriseringen av plast for å gjøre dem harde. Kalsiumperoksid brukes også som en initiator for disse prosessene (Chuangjia Chemical Co, 2011).
Referanser
- KALKSIUMPEROKSID. (2016). Gjenopprettet fra cameochemicals.noaa.gov.
- Kalsiumperoksid. (S.F.). Gjenopprettet fra bakerpedia.com.
- Chuangjia Chemical Co. (2011). Kalsiumperoksid. Gjenopprettet fra chinacjchem.com.
- EMBL-EBI. (2014, 28. juli). kalsiumperoksid. Gjenopprettet fra ebi.ac.uk.
- Kingsfield Inc. (2011). Kalsiumperoksid-CALGRO ™. Gjenopprettet fra kingsfieldinc.
- Sikkerhetsdatablad Kalsiumperoksid. (2013, 21. mai). Gjenopprettet fra sciencelab.com.
- Nasjonalt senter for bioteknologisk informasjon ... (2017, 11. mars). PubChem Compound Database; CID = 14779. Hentet fra PubChem.
- National Library of Medicine. (2015, 19. oktober). KALKSIUMPEROKSID. Gjenopprettet detoxnet.
- Royal Society of Chemistry. (2015). Kalsiumdioksididid. Gjenopprettet fra chemspider.com.


Ingen har kommentert denne artikkelen ennå.