
Isokoriske prosessformler og beregning, hverdagseksempler

EN isokorisk prosess Det er alle termodynamiske prosesser der volumet forblir konstant. Disse prosessene kalles ofte også isometrisk eller isovolumetrisk. Generelt kan en termodynamisk prosess forekomme ved konstant trykk og kalles derfor isobarisk.
Når det skjer ved konstant temperatur, sies det i så fall å være en isoterm prosess. Hvis det ikke er varmeutveksling mellom systemet og miljøet, kalles det adiabatisk. På den annen side, når det er et konstant volum, kalles den genererte prosessen isochorisk.
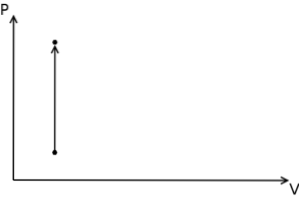
Når det gjelder den isokoriske prosessen, kan det fastslås at trykkvolumarbeidet i disse prosessene er null, siden dette er et resultat av å multiplisere trykket med volumøkningen.
Videre er de isokoriske prosessene i et termodynamisk trykk-volumdiagram representert i form av en vertikal rett linje..
Artikkelindeks
- 1 Formler og beregning
- 1.1 Det første prinsippet om termodynamikk
- 2 Hverdagseksempler
- 2.1 Den ideelle Otto-syklusen
- 3 Praktiske eksempler
- 3.1 Første eksempel
- 3.2 Andre eksempel
- 4 Referanser
Formler og beregning
Det første prinsippet om termodynamikk
I termodynamikk beregnes arbeid ut fra følgende uttrykk:
W = P ∙ ∆ V
I dette uttrykket W er arbeidet målt i Joule, P trykket målt i Newton per kvadratmeter, og ∆ V er endring eller økning i volum målt i kubikkmeter..
På samme måte fastslår det såkalte første prinsippet for termodynamikk at:
∆ U = Q - W
I denne formelen er W arbeidet som gjøres av systemet eller på systemet, Q er varmen som mottas eller sendes ut av systemet, og ∆ U er den interne energivariasjonen i systemet. Ved denne anledningen måles de tre størrelsene i Joule.
Siden arbeidet i en isokorisk prosess er null, viser det seg at:
∆ U = QV (siden, ∆ V = 0, og derfor W = 0)
Med andre ord skyldes variasjonen i systemets indre energi utelukkende varmeutvekslingen mellom systemet og miljøet. I dette tilfellet kalles den overførte varmen konstant volumvarme..
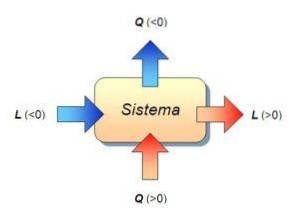
Varmekapasiteten til et legeme eller system skyldes å dele mengden energi i form av varme som overføres til et legeme eller et system i en gitt prosess og endringen i temperatur som den opplever..
Når prosessen utføres med konstant volum, snakker vi om varmekapasitet ved konstant volum, og den er betegnet med Cv (molar varmekapasitet).
Det vil bli oppfylt i så fall:
Spørsmålv = n ∙ Cv ∙ ∆T
I denne situasjonen er n antall mol, Cv er den nevnte molare varmekapasiteten ved konstant volum og ∆T er temperaturøkningen som kroppen eller systemet opplever.
Hverdagseksempler
Det er lett å forestille seg en isokorisk prosess, det er bare nødvendig å tenke på en prosess som skjer ved konstant volum; det vil si hvor beholderen som inneholder materiellet eller materialsystemet ikke endrer volumet.
Et eksempel kan være tilfellet med en (ideell) gass innesluttet i en lukket beholder hvis volum ikke kan endres på noen måte som det tilføres varme. Anta saken med en gass som er lukket i en flaske.
Ved å overføre varme til gassen, som allerede forklart, vil den ende opp med å øke eller øke den indre energien.
Den omvendte prosessen vil være den for en gass som er lukket i en beholder hvis volum ikke kan modifiseres. Hvis gassen blir avkjølt og gir varme til miljøet, vil trykket på gassen bli redusert og verdien av den indre energien til gassen vil reduseres.
Den ideelle Otto-syklusen
Ottosyklusen er et ideelt tilfelle av syklusen som brukes av bensinmaskiner. Den første bruken var imidlertid i maskiner som brukte naturgass eller andre typer drivstoff i gassform..
I alle fall er Ottos ideelle syklus et interessant eksempel på en isokorisk prosess. Det oppstår når forbrenningen av bensin-luftblandingen foregår øyeblikkelig i en forbrenningsbil.
I dette tilfellet er det en økning i temperaturen og trykket til gassen inne i sylinderen, og volumet forblir konstant..
Praktiske eksempler
Første eksempel
Gitt en (ideell) gass innesluttet i en sylinder utstyrt med et stempel, indiker om følgende tilfeller er eksempler på isokoriske prosesser.
- Det arbeides med 500 J på gassen.
I dette tilfellet vil det ikke være en isokorisk prosess, for å utføre arbeid på gassen er det nødvendig å komprimere den, og derfor endre volumet.
- Gassen utvides ved å flytte stempelet horisontalt.
Igjen ville det ikke være en isokorisk prosess, siden utvidelsen av gassen innebærer en endring i volumet.
- Sylinderstemplet er festet slik at det ikke kan bevege seg og gassen blir avkjølt.
Denne gangen ville det være en isokorisk prosess, siden det ikke ville være volumvariasjoner.
Andre eksempel
Bestem variasjonen i intern energi som en gass inneholdt i en beholder med et volum på 10 L utsatt for 1 atm trykk vil oppleve hvis temperaturen stiger fra 34 ºC til 60 ºC i en isokorisk prosess, kjent som dens molare spesifikke varme. Cv = 2,5R (å være R = 8,31 J / mol K).
Siden det er en konstant volumprosess, vil den indre energivariasjonen bare forekomme som en konsekvens av varmen som tilføres gassen. Dette bestemmes med følgende formel:
Spørsmålv = n ∙ Cv ∙ ∆T
For å beregne den tilførte varmen, er det først nødvendig å beregne mol gass i beholderen. For dette er det nødvendig å ty til den ideelle gassligningen:
P ∙ V = n ∙ R ∙ T
I denne ligningen er n antall mol, R er en konstant hvis verdi er 8,31 J / molK, T er temperaturen, P er trykket som gassen utsettes for målt i atmosfærer og T er temperaturen målt i Kelvin.
Løs for n og få:
n = R ∙ T / (P ∙ V) = 0,39 mol
Så det:
∆ U = QV = n ∙ Cv ∙ ∆T = 0,39 ∙ 2,5 ∙ 8,31 ∙ 26 = 210,65 J
Referanser
- Resnik, Halliday & Krane (2002). Fysikk Volum 1. Cecsa.
- Laider, Keith, J. (1993). Oxford University Press, red. Verden for fysisk kjemi.
- Varmekapasitet. (n.d.). I Wikipedia. Hentet 28. mars 2018 fra en.wikipedia.org.
- Latent varme. (n.d.). I Wikipedia. Hentet 28. mars 2018 fra en.wikipedia.org.
- Isokorisk prosess. (n.d.). I Wikipedia. Hentet 28. mars 2018 fra en.wikipedia.org.

Ingen har kommentert denne artikkelen ennå.